
有一种铁的“氧化物”样品,用5mol/L,盐酸200mL恰好完全溶解,所得溶液还能吸收标况下2.24L氯气,恰好使其中Fe2+全部转化成Fe3+,该样品可能的化学式是
A.Fe2O3 B.Fe3O4 C.Fe4O5 D.Fe5O7
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2016届吉林省长春市高三上学期期中测试化学试卷(解析版) 题型:选择题
已知下列热化学方程式:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H= -24.8 kJ·mol-1
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H= -47.2 kJ·mol-1
Fe3O4(s)+CO(g)=3FeO (s)+CO2(g)△H= +640.5 kJ·mol-1
则14g CO气体与足量FeO充分反应得到Fe单质和CO2气体时的反应热为
A.-109kJ•mol-1 B.-218 kJ•mol-1
C.+109 kJ•mol-1 D.+218 kJ•mol-1
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省济南外国语学校高三上学期期中测试化学试卷(解析版) 题型:实验题
实验室中需要22.4L(标准状况)SO2气体。化学小组依据化学方程
Zn+2H2SO4(浓)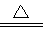 ZnSO4+SO2↑+2H2O计算后,取65g锌粒与质量分数为98%的浓硫酸(密度
ZnSO4+SO2↑+2H2O计算后,取65g锌粒与质量分数为98%的浓硫酸(密度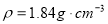 )110mL充分反应,锌全部溶解,对于制得的气体,有同学认为可能混有杂质。
)110mL充分反应,锌全部溶解,对于制得的气体,有同学认为可能混有杂质。
(1)化学小组所制得的气体中混有的主要杂质气体可能是 (填分子式)。产生这种结果的主要原因是 (用化学方程式和必要的文字加以说明)
(2)为证实相关分析,化学小组的同学设计了实验,组装了如下装置,对所制取的气体进行探究。

①装置B中加入的试剂 ,作用是 。
②装置D加入的试剂 ,装置F加入的试剂 。
③可证实一定量的锌粒和一定量的浓硫酸反应后生成的气体中混有某杂质气体的实验现象是 。
④U型管G的作用为 。
查看答案和解析>>
科目:高中化学 来源:2016届山东省高三上10月阶段质检化学试卷(解析版) 题型:选择题
下列各组关于强电解质、弱电解质、非电解质的归类,完全正确的是
A | B | C | D | |
强电解质 | Fe | NaCl | CaCO3 | HNO3 |
弱电解质 | CH3COOH | NH3 | H3PO4 | Fe(OH)3 |
非电解质 | C12H22O11(蔗糖) | BaSO4 | C2H5OH | H2O |
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河南洛阳高级中学高二上9月月考化学试卷(解析版) 题型:选择题
下列有关说法不正确的是
A.反应NH3(g)+HCl(g)===NH4Cl(s)在室温下可自发进行,则该反应的ΔH<0
B.CaCO3(s)===CaO(s)+CO2(g)室温下不能自发进行,说明该反应的ΔH<0
C.一定温度下,反应MgCl2(l)===Mg(l)+Cl2(g)的ΔH>0,ΔS>0
D.常温下,反应C(s)+CO2(g)===2CO(g)不能自发进行,则该反应的ΔH>0
查看答案和解析>>
科目:高中化学 来源:2016届湖南省常德市高三上学期第三次月考化学试卷(解析版) 题型:选择题
下列离子方程式中正确的是
A.FeO溶于稀硝酸中:FeO+2H+ = Fe2++H2O
B.过量氨水加入AlCl3溶液中:Al3++3OH?= Al(OH)3↓
C.金属钠溶于水中:Na+H2O = Na++OH?+H2↑
D.过量CO2通入NaOH溶液中:OH?+CO2 = HCO3?
查看答案和解析>>
科目:高中化学 来源:2016届浙江省高三上学期10月月考化学试卷(解析版) 题型:选择题
下列说法不正确的是
A.在人类研究物质微观结构的过程中,先后使用了光学显微镜、电子显微镜、扫描隧道显微镜三种不同层次的观测仪器
B.铝硅酸盐分子筛可用于物质分离,还可用作干燥剂、催化剂及催化剂载体
C.使用可再生资源、提高原子经济性、推广利用二氧化碳与环氧丙烷生成的可降解高聚物等都是绿色化学的内容
D.铁盐会水解产生具有吸附性的胶体粒子,可用于饮用水的杀菌消毒
查看答案和解析>>
科目:高中化学 来源:2016届湖北省高三上学期10月调考理综化学试卷(解析版) 题型:实验题
(14分)工业上利用硫铁矿烧渣(主要成分为Fe3O4、Fe2O3、FeO、SiO2)为原料制备高档颜料——铁红(Fe2O3),具体生产流程如下:

试回答下列问题:
(1)“酸溶”过程中Fe3O4发生反应的离子反应方程式为 ;
(2)实验室实现“步骤Ⅱ”中分离操作所用的玻璃仪器有 、玻璃棒和烧杯等;步骤Ⅳ中应选用 试剂调节溶液的pH(填字母编号)。
A.稀硝酸 B.氢氧化钠溶液 C.高锰酸钾溶液 D.氨水
(3)检验步骤Ⅲ已经进行完全的试剂是 ;
(4)步骤Ⅴ的反应温度一般需控制在35℃以下,其目的是 ;
(5)步骤Ⅵ中发生反应的化学反应方程式为 ;
(6)步骤Ⅴ中,FeCO3达到沉淀溶解平衡时,若室温下测得溶液的pH为8.5,c(Fe2+)=1×10-6 mol·L-1。试判断所得的FeCO3中是否含有Fe(OH)2 (填“是”或“否”),请通过简单计算说明理由。
(已知:Ksp[Fe(OH)2]=4.9×10-17);
(7)欲测定硫铁矿矿渣中Fe元素的质量分数,称取ag样品,充分“酸溶”、“水溶”后过滤,向滤液中加入足量的H2O2,充分反应后加入NaOH溶液至不再继续产生沉淀,经过滤、洗涤、灼烧至固体恒重,冷却后称得残留固体bg,测得该样品中Fe元素的质量分数为 。
查看答案和解析>>
科目:高中化学 来源:2016届上海市高三上学期摸底测试化学试卷(解析版) 题型:实验题
实验题(共9分)
下图所示为常见气体制备、分离、干燥和性质验证的部分仪器装置(加热设备及夹持固定装置均略去),请根据要求完成下列各题(仪器装置可任意选用,必要时可重复选择,a、b为活塞)。
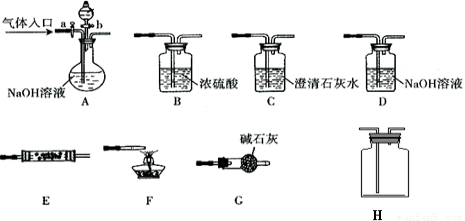
1.实验前,如何检查A装置的气密性: 。
2.若气体入口通入CO和CO2的混合气体,E内放置CuO,选择装置获得纯净干燥的CO,并验证其还原性及氧化产物,所选装置的连接顺序为 (填代号)。能验证CO氧化产物的现象是 。
34.若A中气体入口改通空气,分液漏斗内改加浓氨水,圆底烧瓶内改加NaOH固体,E内放置铂铑合金网,H为空瓶,D中改为石蕊试液,按A→G→E→H→D装置顺序制取干燥的氨气,并验证氨的某些性质。
①实验中先用酒精灯加热催化管,再通入混合气体,可观察到H内有红棕色气体出现,D中石蕊试液变红,则E中发生反应的方程式为 。
②若把酒精灯撤去,继续通入气体,催化剂可继续保持红热状态,反应继续进行。能使催化剂继续保持红热的原因是: 。
③某同学在做上述实验时出现了与其他同学不同的现象,他发现催化剂红热现象明显而正常,但石蕊试液不变红。请分析可能的原因:(答1点即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com