
下图是几种常见有机物之间的转化关系,有关说法正确的是( )

A. 有机物a只能是淀粉
B. 反应①、②、③均为取代反应
C. 有机物c可以使酸性高锰酸钾溶液褪色
D. 有机物d的羧酸类同分异构体只有1种
科目:高中化学 来源:湖南省长沙市2016-2017学年高一上学期期末考试化学试卷 题型:选择题
下列实验方案设计中,可行的是
A. 用萃取的方法分离汽油和煤油
B. 加稀盐酸后过滤,除去混在铜粉中的少量镁粉和铝粉
C. 用溶解过滤的方法分离KNO3和NaCl固体的混合物
D. 将O2和H2的混合气体通过灼热的氧化铜,以除去其中的H2
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省南昌市高二上学期期末考试化学试卷(解析版) 题型:实验题
某学生在如图所示的装置中用苯和液溴制取溴苯,请根据下列实验步骤回答有关问题。
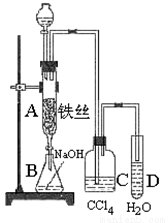
(1)写出A中发生的有机反应的化学方程式_____________________;
(2)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是____________,然后用_______________仪器分离出溴苯(仍含有少量苯);
(3)反应完毕后,向试管D中滴加AgNO3溶液有_______(填现象)生成,此现象说明这种获得溴苯的反应属于________反应(填有机反应类型)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省南昌市高二上学期期末考试化学试卷(解析版) 题型:选择题
下列物质与水混合后静置,不出现分层的是
A. 苯 B. 乙醇 C. 氯仿 D. 正戊烷
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省揭阳市高二下学期第一次月考理科综合化学试卷(解析版) 题型:填空题
碳、氮和铝的单质及其化合物在工农业生产和生活中有重要用途。
(1)真空碳热还原—氧化法可实现由铝矿制备金属铝,其相关的热化学方程式如下:
Al2O3(s)+AlCl3(g)+3C(s)═3AlCl(g)+3CO(g) △H=akJ·mol-1
3AlCl(g)═2Al(l)+AlCl3(g) △H=bkJ·mol-1
反应Al2O3(s)+3C(s)═2Al(l)+3CO(g)的△H=_________kJ·mol-1(用含a、b的代数式表示);
(2)用活性炭还原法可以处理氮氧化物。某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g) N2(g)+CO2(g) △H=Q kJ·mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g) △H=Q kJ·mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
时间 物质 | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
①0~10min内,NO的平均反应速率v(NO)=___________,T1℃时,该反应的平衡常数K=_______
②30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是__________(填字母编号)。
a.通入一定量的NO b.通入一定量的N2
c.适当升高反应体系的温度 d.加入合适的催化剂
e.适当缩小容器的体积
③在恒容条件下,能判断该反应一定达到化学平衡状态的依据是_________(填选项编号)。
a.单位时间内生成2nmolNO(g)的同时消耗nmolCO2(g)
b.反应体系的压强不再发生改变
c.混合气体的密度保持不变
d.混合气体的平均相对分子质量保持不变
④若保持与上述反应前30min的反应条件不变,起始时NO的浓度为2.50mol/L,则反应达平衡时c(NO)=_______ mol/L。NO的转化率_______(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源:2017届江西省、临川一中高三1月联考理综化学试卷(解析版) 题型:简答题
碳酸二甲酯(CH3OCOOCH3,简称DMC),是一种应用前景广泛的新材料,实验室中可用甲醇、CO、CO2等进行合成。回答下列问题:
(1)二氧化碳的电子式为 _________________
(2)用甲醇、CO、O2在常压、70~120℃和催化剂的条件下合成DMC。
已知:①CO的标准燃烧热为:?283.0kJ•mol?1,
②1mol H2O(l)完全蒸发变成H2O(g)需吸收44kJ的热量
③2CH3OH(g)+CO2(g)?CH3OCOOCH3(g)+H2O(g)△H=?15.5kJ•mol?1
则2CH3OH(g)+CO(g)+1/2O2(g)?CH3OCOOCH3 (g)+H2O(l)△H=_____。
该反应在常压和70~120℃条件下就能自发反应的原因是_______________。
(3)由上述反应可知甲醇和CO2可直接合成DMC但甲醇转化率通常不会超过1%,制约该反应走向工业化生产.
①写出该反应平衡常数表达式:______________ ;
②在恒容密闭容器中发生上述反应,能说明已达到平衡状态的是____(选填编号).
A.v正(CH3OH)=2v逆(CO2)
B.CH3OCOOCH3与H2O的物质的量之比保持不变
C.容器内气体的密度不变D.容器内压强不变
③某研究小组在某温度下,在100mL恒容密闭容器中投入2.5mol CH3OH(g)、适量CO2和6×10?5 mol催化剂,研究反应时间对甲醇转化数(TON)的影响,其变化曲线如图1所示.(计算公式为:TON=转化的甲醇的物质的量/催化剂的物质的量)。
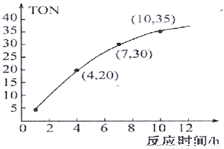
在该温度下,最佳反应时间是_________h;4~10h内DMC的平均反应速率是_______ .
(4)以多孔铂为电极,在如下图装置中A、B口分别通入CH3OCOOCH3和O2构成燃料电池,请写出该电池负极的电极反应式____________________________
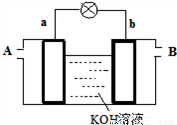
查看答案和解析>>
科目:高中化学 来源:2017届江西省、临川一中高三1月联考理综化学试卷(解析版) 题型:选择题
短周期元素A、B、C、D最高价氧化物对应水化物分别为X、Y、Z、W,A是短周期中原子半径最大的元素,常温下X、Z、W均可与Y反应,A、C、D的原子序数及0.1mol/L X、Z、W溶液的pH如图所示(已知lg2=0.3).下列说法正确的是( )
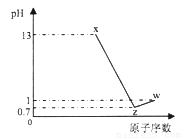
A. A的离子半径小于B的离子半径
B. W、X两物质含有的化学键类型相同
C. D氢化物稳定性小于C氢化物稳定性
D. B的简单离子会影响水的电离平衡
查看答案和解析>>
科目:高中化学 来源:2017届江苏省、溧水高级中学)等六校高三2月联考化学试卷(解析版) 题型:选择题
下列说法正确的是
A. 铅蓄电池放电一段时间后,负极质量减小,正极质量增加
B. 298K时,2H2S(g)+SO2(g)=3S(s)+2H2O(l)能自发进行,则其ΔH<0
C. pH=3的盐酸与pH=11的某碱溶液等体积混合,溶液呈碱性,说明该碱为强碱
D. 标准状况下,22.4L甘油中含有3mol羟基(—OH)
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三下学期开学考试化学试卷(解析版) 题型:简答题
高铁酸钾(K2FeO4)具有强氧化性,可作为水处理剂和高容量电池材料。工业上生产高铁酸钾的工艺流程如下:
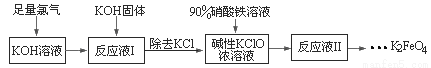
已知K2FeO4具有下列性质:①可溶于水,微溶于KOH溶液,难溶于异丙醇;②在0℃-5℃,强碱性溶液中比较稳定;③在Fe3+和Fe(OH)3催化作用下发生分解;④在酸性至弱碱性条件下,能与水反应生成Fe(OH)3和O2
请完成下列填空:
(1)已知Cl2与KOH在低温下可制得KClO,请写出化学反应方程式____________。
(2)在“反应液Ⅰ”中加KOH固体的目的是____________________。
(3)生产K2FeO4的化学反应方程式为________________,制备K2FeO4时,须将Fe(NO3)3溶液缓慢滴加到碱性的KClO浓溶液中,并且不断搅拌,采用这种混合方式的原因是___________________。
(4)请补充完整由“反应液Ⅱ”得到K2FeO4晶体的实验步骤。(可选用的试剂:NaOH溶液、KOH溶液、蒸馏水和异丙醇)
① 向反应液Ⅱ中加入饱和________,在冰水浴中静置结晶后过滤,得K2FeO4粗产品;
② 将K2FeO4粗产品溶解在___________中,再次在冰水浴中静置结晶后过滤,得到较纯净的K2FeO4;
③ 将K2FeO4晶体再用少量__________洗涤,低温真空干燥,得到高铁酸钾成品。
(5)从“反应液Ⅱ”中分离出K2FeO4晶体后,可以得到的副产品有_________(写化学式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com