
下列溶液与20 mL 1 mol•L﹣1 NaNO3溶液中NO3﹣物质的量浓度相等的是
A.10 mL 0.5 mol•L﹣1 Cu(NO3)2溶液
B.5 mL 0.8 mol•L﹣1 Al(NO3)3溶液
C.10 mL 2 mol•L﹣1 AgNO3溶液
D.10 mL 1 mol•L﹣1 Mg(NO3)2溶液
科目:高中化学 来源:2016届河北正定中学高三上学期第五次月考理科综合化学试卷(解析版) 题型:填空题
过渡金属元素及其化合物的应用广泛,是科学家们进行前沿研究的方向之一。
(1)测定土壤中铁的含量时需先将三价铁还原为二价铁,再采用邻啡罗啉做显色剂,用比色法测定,若土壤中含有高氯酸盐时会对测定有干扰。相关的反应如下:
4FeCl3+2NH2OH•HCl=4FeCl2+N2O↑+6HCl+H2O
①基态Fe原子中,电子占有的最高能层符号为__________,核外未成对电子数为__________,Fe3+在基态时,外围电子排布图为______________________________。
②羟胺中(NH2OH)采用sp3杂化的原子有_______________,三种元素电负性由大到小的顺序为________;与ClO4-互为等电子体的分子的化学式为_______________________。
(2) 过渡金属原子可以与CO分子形成配合物,配合物价电子总数符合18电子规则。如Cr可以与CO形成Cr(CO)6分子:价电子总数(18)=Cr的价电子数(6)+CO提供电子数(2×6)。Fe、Ni两种原子都能与CO形成配合物,其化学式分别为_____________、______________。
(3) Pt2+的常见配合物Pt(NH3)2Cl2存在 两种不同的结构:一种为淡黄色(Q),不具有抗癌作用,在水中的溶解度较小;另一种为黄绿色(P),具有抗癌作用,在水中的溶解度较大。
两种不同的结构:一种为淡黄色(Q),不具有抗癌作用,在水中的溶解度较小;另一种为黄绿色(P),具有抗癌作用,在水中的溶解度较大。
①Q是_________________分子(选填“极性”或“非极性”)。
②P分子的结构简式为__________________________。
(4)NiXO晶体晶胞结构为NaCl型,由于晶体缺陷,x值为0.88,晶胞边长为a pm。晶胞中两个Ni原子之间的最短距离为___________pm。若晶体中的Ni分别为Ni2+、Ni3+,此晶体中Ni2﹢与Ni3﹢的最简整数比为_________。
查看答案和解析>>
科目:高中化学 来源:2015-2016北京大学附中宇华教育集团高一12月化学卷(解析版) 题型:选择题
下列说法中正确的是( )
A.在化学反应过程中,发生物质变化的同时不一定发生能量变化
B.生成物全部化学键形成时所释放的能量大于破坏反应物全部化学键所吸收的能量时,反应为 吸热反应
吸热反应
C.反应产物的总焓大于反应物的总焓时,反应吸热,ΔH>0
D.ΔH的大小与热化学方程式的计量系数无关
查看答案和解析>>
科目:高中化学 来源:2015-2016学年贵州省高二上二次月考化学试卷(解析版) 题型:选择题
在某一容积为2 L的密闭容器中,加入0.2 mol的CO和0.2 mol的H2O,在催化剂存在的条件下,高温加热,发生如下反应:CO(g)+H2O(g) CO2(g)+H2(g) ΔH=—a kJ/mol(a>0),反应达平衡后,测得c(CO)∶c(CO2)=3∶2,下列说法正确的是
CO2(g)+H2(g) ΔH=—a kJ/mol(a>0),反应达平衡后,测得c(CO)∶c(CO2)=3∶2,下列说法正确的是
A.反应放出的热量为0.04a kJ
B.若将容器的体积压缩为1 L,有利于该平衡正向移动
C.平衡时H2O的转化率为40%
D.CO、H2O、CO2、H2的浓度都相等时反应达到平衡
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁实验中学分校高一上12月月考化学卷(解析版) 题型:选择题
下列关于金属的叙述中正确的是
A.所有的金属都是固态的
B.金属具有导电性、导热性和延展性
C.活泼的金属、或较活泼的金属能与酸反应,但不能与碱反应
D.金属元素在自然界中都是以化合态存在的
查看答案和解析>>
科目:高中化学 来源:2016届云南师大附属中学高三上适应性月考理综化学试卷(解析版) 题型:填空题
硫及其化合物有广泛应用。
(l)硫酸生产过程中涉及以下反应。已知25℃、10lkPa时:
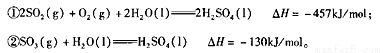
则SO2催化氧化为SO3(g)的热化学方程式为
(2)对于SO2催化氧化为SO3的反应。
①图甲是SO2(g)和SO3(g)的浓度随时间t的变化情况。反应从开始到达到平衡时,用O2表示的平均反应速率为
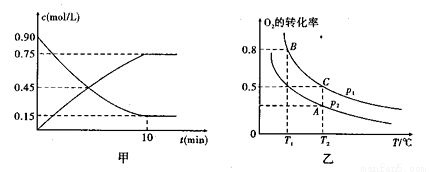
②在一容积可变的密闭容器中充入20mol SO2(g)和10mol O2(g),O2的平衡转化率随温度(T)、压强(p)的变化如图乙所示。则p1与p2的大小关系是p1 p2:(填“>”“<”或“=”);A、B、C三点的平衡常数大小关系为 (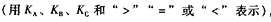 ),理由是
),理由是
(3)工业生产硫酸过程中,通常用氨水吸收尾气
①如果在25℃时,相同物质的量的SO2与NH3溶于水,发生反应的离子方程式为
所得溶液中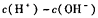 = (填序号)。
= (填序号)。
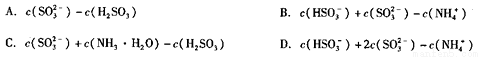
②已知在25℃时NH3·H2O、H2SO3电离平衡常数如下表,则上述所得溶液中,各离子浓度由大到小的顺序为

查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高二上期中测试化学试卷(解析版) 题型:选择题
(改编)为了测定酸碱反应的中和热,计算时至少需要的数据是
①酸的浓度和体积;②碱的浓度和体积;③比热容;④反应后溶液的质量;⑤生成水的质量;⑥前后温度的变化;⑦操作所需时间
A.①②④⑥ B.③④⑤⑥ C.①③④⑤ D.全部
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西省高二上12月月考化学试卷(解析版) 题型:选择题
已知298K时,Mg(OH)2的溶度积常数KSP=5.6×10-12,取适量的MgCl2溶液,加入一定量的烧碱溶液达到沉淀溶解平衡,测得pH=13.0,则下列说法不正确的是
A.所得溶液中的c(H+)=10-13 mol/L
B.所加烧碱溶液的pH=13.0
C.所得溶液中由水电离出的c(OH-)=10-13 mol/L
D.所得溶液中的c(Mg2+)=5.6×10-10 mol/L
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广西省钦州市钦南区高二上学期期中测试化学试卷(解析版) 题型:填空题
氯元素是生产生活中常见的非金属元素。
(1)将Cl2通入NaOH溶液中得到以NaClO为有效成分的漂白液,写出该反应的离子方程式 ;不直接用Cl2作漂白剂的原因是 (写出两条)。
(2)使用Cl2为自来水消毒时,会与水中的有机物生成对人体有害的有机氯化物。下列物质中可以替代Cl2为自来水杀菌消毒的是 (填字母序号)。
a.臭氧 b.NH3 c.明矾 d.ClO2
(3)生物质混煤燃烧是当今能源燃烧利用的最佳方式之一,但生物质中氯含量较多,燃烧过程中会形成金属氯化物(如NaCl)和Cl2等物质,对金属炉壁造成腐蚀。
①NaCl和Cl2中化学键的类型分别是 和 。
②燃煤过程中生成的SO2会与NaCl等物质发生反应,生成硫酸盐和Cl2。若生成Cl2 22.4 L(标况)时转移电子数为4×6.02×1023,该反应的化学方程式是 。
③已知:2H2O2(l)=2H2O(l)+O2(g) ΔH1 = -196.46 kJ·mol-1
H2(g)+1/2O2(g)= H2O(l) ΔH2 = -285.84 kJ·mol-1
Cl2(g)+H2(g)=2HCl(g) ΔH3 = -184.60 kJ·mol-1
在催化剂作用下,用H2O2(l)可除去上述燃烧过程中产生的Cl2。依据上述已知反应,写出该反应的热化学方程式: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com