
【题目】张青莲是我国著名的化学家,1991年他准确测得In的相对原子质量为114.818,被国际相对原子质量委员会采用为新的标准值.这是相对原子质量表中首次采用我国测定的相对原子质量值.则下列关于 ![]() In的说法中,错误的是( )
In的说法中,错误的是( )
A.![]() In原子核外有49个电子
In原子核外有49个电子
B.![]() In原子核内有49个中子
In原子核内有49个中子
C.![]() In原子核内质子数和中子数之和等于其质量数,为115
In原子核内质子数和中子数之和等于其质量数,为115
D.![]() In是In元素的一种核素
In是In元素的一种核素
科目:高中化学 来源: 题型:
【题目】如图为实验室制备蒸馏水的装置示意图,根据图示回答下列问题. 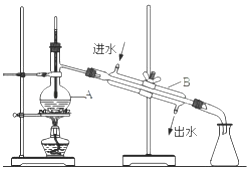
(1)图中的两处明显错误是、 .
(2)A 仪器的名称是 , B 仪器的名称是 .
(3)实验时 A中除加入适量自来水外,还需加入少量 , 其作用是 . 若蒸馏开始后发现忘记加入该物质,补救办法是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以铬铁矿(主要成分为FeOCr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O72H2O),其主要反应为: ①4FeOCr2O3+8Na2CO3+7O2 ![]() 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
②2Na2CrO4+H2SO4Na2SO4+Na2Cr2O7+H2O
下列说法中正确的是( )
A.反应①和②均为氧化还原反应
B.反应①的氧化剂是O2 , 还原剂是FeOCr2O3
C.高温下,O2的氧化性大于Fe2O3小于Na2CrO4
D.生成1mol的Na2Cr2O7时共转移5mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】气体的体积主要由以下什么因素决定的:①气体分子的直径②气体物质的量的多少③气体分子间的平均距离 ④气体分子的相对分子质量
A.①② B.①③ C.②③ D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L密闭容器内,800℃时反应2NO(g)+O2(g) ![]() 2NO2(g)体系中,n(NO)随时间的变化如下表:
2NO2(g)体系中,n(NO)随时间的变化如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)写出该反应的平衡常数表达式:K=__________。
(2)0~2 s内该反应的平均速率v(NO)=__________, v(O2)=__________。
(3)能说明该反应已达到平衡状态的是__________。
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内密度保持不变
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是__________。
a.及时分离出NO2气体 b.增大O2的浓度
c.扩大容器体积 d.选择高效催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1.52g铜镁合金完全溶解于50mL密度为1.40gmL﹣1、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体 1 120mL(标准状况),向反应后的溶液中加入1.0molL﹣1NaOH溶液,当金属离子全部沉淀时,得到2.54g沉淀.下列说法不正确的是
A. 得到2.54 g沉淀时,加入NaOH溶液的体积是640 mL
B. 该浓硝酸中HNO3的物质的量浓度是14.0 molL﹣1
C. NO2和N2O4的混合气体中,NO2的体积分数是80%
D. 该合金中铜与镁的物质的量之比是1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酰苯胺作为一种常用药,具有解热镇痛的效果.实验室制备乙酰苯胺时,可以用苯胺与乙酸酐或与冰醋酸加热来制取,苯胺与乙酸酐的反应速率远大于与冰醋酸反应的速率,已知苯胺微溶于冷水;纯乙酰苯胺是无色片状晶体,熔点114℃,不溶于冷水,可溶于热水;乙酸酐遇水缓慢反应生成乙酸;现选用苯胺与乙酸酐为原料制取和提纯乙酰苯胺,该放热反应的原理:
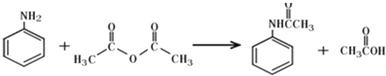
实验步骤
①取5.0mL苯胺(密度1.04g/mL),倒入100mL锥形瓶中,加入20mL水,在旋摇下分批加入6.0mL乙酸酐(密度1.08g/mL),搅拌均匀.若有结块现象产生,用玻璃棒将块状物研碎,再充分搅拌;
②反应完全后,及时把反应混合物转移到烧杯中,冷却后,抽滤,洗涤,得粗乙酰苯胺固体;
③将粗产品转移至150mL烧杯中,加入适量水配制成80℃的饱和溶液,再加入过量20%的水.稍冷后,加半匙活性炭,搅拌下将溶液煮沸3~5min,过滤Ⅰ,用少量沸水淋洗烧杯和漏斗中的固体,合并滤液,冷却结晶,过滤Ⅱ、洗涤、晾干得乙酰苯胺纯品.
(1)步骤①研碎块状产物的用意在于________________________________;反应温度过高会导致苯胺挥发,下列可以控制反应温度,防止反应温度升高过快的操作有__;
A.反应快结束时的充分搅拌 B.旋摇下分批加入6.0mL乙酸酐
C.玻璃棒将块状物研碎 D.加20mL水
(2)步骤②洗涤粗产品时,选用的溶剂是_______;
A.热水 B.冷水 C.1:3的乙醇溶液 D.滤液
(3)步骤③两次用到过滤,其中过滤Ⅰ选择________(过滤、趁热过滤或抽滤),过滤Ⅰ操作是为了除去_____________;配制热溶液时,加入过量溶剂的作用是___________(选出正确选项);
A.防止后续过程中,溶剂损失可能产生的产物析出
B.防止后续过程中,温度降低可能产生的产物析出
C.除去活性炭未吸附完全的有色杂质
(4)步骤③冷却滤液时可选择__;
A.冰水浴冷却 B.搅拌下水浴冷却
C.室温下自然冷却 D.投入少量碎冰后静置
(5)步骤③中以下哪些操作不能提高产率__________;
①配制成饱和溶液后,加入过量20%的溶剂;②趁热过滤近沸溶液;③过滤Ⅰ时用少量沸水淋洗烧杯和漏斗中的固体,合并滤液;④加活性炭吸附;⑤过滤Ⅱ时的洗涤选用热水代替冷水洗涤固体.
A.①④⑤ B.①④ C.④⑤ D.②④⑤
(6)步骤③最后测得纯乙酰苯胺固体6.75g,已知苯胺、乙酸酐和乙酰苯胺的摩尔质量分别为93g/mol、102g/mol、135g/mol.该实验的产率为________(保留两位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有m g某气体,它由双原子分子构成,它的摩尔质量为M gmol﹣1 . 若阿伏加德罗常数用NA表示,则:
(1)该气体的物质的量为;
(2)该气体所含原子总数为个;
(3)该气体在标准状况下的体积为;
(4)该气体溶于1L水中(不考虑反应),其溶液中溶质的质量分数为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Fe2O3(s)+3CO(g)2Fe(s)+3CO2(g)在不同温度下的平衡常数如表:
温度/℃ | 1000 | 1150 | 1300 |
平衡常数 | 42.9 | 50.7 | 64.0 |
请回答下列问题:
(1)该反应的平衡常数表达式K= ______ ,△H ______ 0(填“>”、“<”或“=”)。
(2)在一个容积为10L的密闭容器中,1300℃时加入Fe、Fe2O3、CO、CO2各1mol,反应经过10min后达到平衡.求该时间范围内反应的平均反应速率v(CO2)= ______ ,CO的平衡转化率为 ______。
(3)欲提高(2)中CO的平衡转化率,可采取的措施是 ______。
A.增加Fe2O3的量B.加入合适的催化剂C.移出部分CO2D.提高反应温度.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com