
分析 (1)发生2NaOH+2Al+2H2O=2NaAlO2+3H2↑,结合反应及n=$\frac{m}{M}$、V=nVm计算;
(2)反应中Cu元素化合价由CuSO4中+2价降低为Cu2S中+1价,FeS2中S元素的化合价由-1价分别升高到+6价和降低到-2价;
(3)1.56g Al(OH)3沉淀的物质的量为$\frac{1.56g}{78g/mol}$=0.02mol,n(AlCl3)=0.05mol,氯化铝有剩余或恰好完全反应,碱不足只发生Al3++3OH-═Al(OH)3↓,碱过量发生:Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-═AlO2-+2H2O,以此来计算解答.
解答 解:(1)n(Al)=$\frac{5.4g}{27g/mol}$=0.2mol,由2NaOH+2Al+2H2O=2NaAlO2+3H2↑,n(NaOH)=0.2mol,n(H2)=0.3mol,则参加反应的NaOH的物质的量浓度$\frac{0.2mol}{0.2L}$=1mol/L,生成标况下氢气的体积0.3mol×22.4L/mol=6.72L,故答案为:1mol/L;6.72L;
(2)在反应中14CuSO4+5FeS2+l2H2O═7Cu2S+5FeSO4+12H2SO4,Cu元素化合价由CuSO4中+2价降低为Cu2S中+1价,Cu元素化合价降低,被还原,CuSO4为氧化剂,Cu2S是还原产物,FeS2中S元素的化合价由-1价分别升高到+6价和降低到-2价,则FeS2既为氧化剂又为还原剂,Cu2S是还原产物,5molFeS2和14molCuSO4正好反应,反应过程中Cu得电子:14×1 mol=14 mol,S得电子:7×1 mol=7 mol,S失电子:3×7 mol=21 mol,反应中电子转移了21 mol;则当有5mol FeS2发生反应时,转移电子为21mol,
故答案为:FeS2;还原产物;21;
(3)1.56g Al(OH)3沉淀的物质的量为$\frac{1.56g}{78g/mol}$=0.02mol,n(AlCl3)=0.05mol,
碱不足时,由Al3++3OH-═Al(OH)3↓可知,n(NaOH)=0.06mol,c(NaOH)=$\frac{0.06mol}{0.1L}$=0.6mol/L;
若碱过量,则
Al3++3OH-═Al(OH)3↓
0.05mol 0.15mol 0.05mol
Al(OH)3+OH-═AlO2-+2H2O
0.03mol 0.03mol
则n(NaOH)=0.15mol+0.03mol=0.18mol,
c(NaOH)=$\frac{0.18mol}{0.1L}$=1.8mol/L,
故答案为:0.6mol/L或1.8mol/L.
点评 本题考查氧化还原反应及物质的量浓度的计算,为高考常见题型和高频考点,侧重于学生的分析能力和计算能力的考查,注意从元素化合价的角度认识氧化还原反应的相关概念和物质的性质,难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题


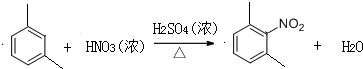 ,反应类型为取代反应或硝化反应;
,反应类型为取代反应或硝化反应;
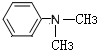 (写结构简式).
(写结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
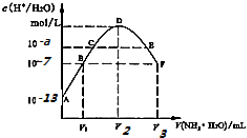
| A. | 稀硫酸的浓度为0.1mol/L | |
| B. | C点溶液pH=14-a | |
| C. | E溶液中存在:c(NH4+)>c(SO42-)>c(H+)>c(OH-) | |
| D. | B到D、D到F所加氨水体积一定相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHSO4在熔融状态下的电离方程为:NaHSO4═Na++H++SO42- | |
| B. | 在0.1m0L,L-1醋酸中加水,可使$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$增大 | |
| C. | 升温可使电离平衡NH3•H2O?NH4++OH-向左移动 | |
| D. | 向氯水中加人少量氢氧化钠溶液可使溶液中的c(HClO)增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上第一次月考化学卷(解析版) 题型:选择题
以Pt为电极,电解含有0.10molM+和0.10molN3+(M+、N3+均为金属阳离子)的溶液,阴极析出金属单质或气体的总物质的量(y)与导线中通过电子的物质的量(x)的关系如右图。对离子氧化能力的强弱判断正确的是(选项中H+为氢离子)

A.M+>H+>N3+
B .M+>N3+>H+
.M+>N3+>H+
C.N3+>H+>M+
D.条件不足,无法确定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com