
利用维生素C能使淀粉—碘溶液褪色的性质,通过实验(如图)比较加入苹果汁和橙汁的多少来确定它们中维生素C含量的多少。要得出正确结论,在实验时需要控制的条件是( )
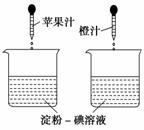
①实验时必须向两烧杯中同时等速滴加液体 ②淀粉-碘溶液的体积和浓度必须相等 ③胶头滴管滴出的果汁的滴数必须相等 ④胶头滴管滴出的每滴果汁的体积必须相等
A.①③ B.②④
C.② D.④
科目:高中化学 来源: 题型:
将0.03molCl2缓缓通入含0.02molH2SO3和0.02mol HBr的混合溶液中,在此过程中,溶液的[H+]与Cl2用量的关系示意图是(溶液的体积示为不变) ( )

查看答案和解析>>
科目:高中化学 来源: 题型:
(1)化学是一门以实验为基础的学科,化学实验是化学学习的重要内容。 根据你掌握的知识判断,下列实验操作的描述中,正确的是________(填写下列各项序号)。
根据你掌握的知识判断,下列实验操作的描述中,正确的是________(填写下列各项序号)。
A.从试剂瓶中取出的任何药品,若有剩余不能再放回原试剂瓶
B.用稀盐酸洗涤盛放过石灰水的试剂瓶
C.配制H2SO4溶液时,可先在量筒中加入一定体积的水,再在搅拌下慢慢加入浓硫酸
D.各放一张质量相同的滤纸于天平的两托盘上,将NaOH固体放在左盘纸上称量
E.Na2CO3溶液不能保存在带有玻璃塞的试剂瓶中
F.将用水润湿的pH试纸浸入 稀盐酸中,测定溶液的pH
稀盐酸中,测定溶液的pH
(2)化学实验中,不正确的操作会对实验结果的准确性造成一定的影响,请用“>”、“<”或“=”填写下列空白:
①实验时未用标准溶液润洗滴定管,则测得锥形瓶中待测液的浓度________实际浓度。
②用托盘天平称取10.4 g氯化钠,若将砝码和氯化钠的位置放颠倒了,所称取氯化钠的质量________________________________________________________________10.4 g。
③用容量瓶配制500 mL 0.1 mol·L-1NaOH溶液,定容时仰视刻度线,所得溶液的物质的量浓度________0.1 mol·L-1。
(3)玻璃棒是中学化学实验中常用的仪器。下列过程中,一般不需要玻璃棒的是________(填写编号)。
①用pH试纸测定Na2CO3溶液的pH
②配制一定物质的量浓度的氯化钠溶液
③将适量氯化铁饱和溶液滴入沸水中制备氢氧化铁胶体
④探究Ba(OH)2·8H2O晶体和NH4Cl晶体反应过程中的能量变化
⑤实验室用新制备的FeSO4溶液和预处理过的NaOH溶液制备Fe(OH)2白 色沉淀
色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验中,所选装置不合理的是
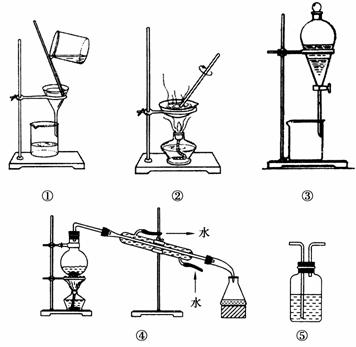
A.分离Na2CO3溶液和CH3COOC2H5,选④
B.用CCl4提取碘水中的碘,选③
C.用FeCl2溶液吸收Cl2,选⑤
D.粗盐提纯,选①和②
查看答案和解析>>
科目:高中化学 来源: 题型:
标准氢氧化钠溶液中和醋酸时,当溶液的pH等于7,则此时( )
A.醋酸和氢氧化钠的物质的量相等
B.醋酸和氢氧化钠完全中和
C.氢氧化钠过量
D.醋酸有剩余
查看答案和解析>>
科目:高中化学 来源: 题型:
能正确表示下列反应的离子方程式是( )
A.将铜屑加入Fe3+溶液中:2Fe3++Cu===2Fe2++Cu2+
B.将磁性氧化铁溶于盐酸:Fe3O4+8H+===3Fe3++4H2O
C.将氯化亚铁溶液和稀硝酸混合:3Fe2++4H++NO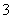 ===3Fe3++2H2O+NO↑
===3Fe3++2H2O+NO↑
D.将铁粉加入稀硫酸中:2Fe+6H+===2Fe3++3H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应能说明卤素非金属性活泼顺序是Cl>Br>I的是 ( )
①2HClO4+Br2(气) = 2HBrO4+Cl2 ②2NaBr+Cl2 = 2NaCl+Br2
③2KI+Cl2 = 2KCl+I2 ④2KI+Br2 = 2KBr+I2
A.①②③ B.①②④ C.②③④ D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
研究NO2、SO2 、CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,相应的化学反应方程式为 。利用反应6NO2+ 8NH3 7N5+12H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是 L。
7N5+12H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是 L。
(2)已知:2SO2(g)+O2(g) 2SO3(g) ΔH=-196.6 kJ·mol-1
2SO3(g) ΔH=-196.6 kJ·mol-1
2NO(g)+O2(g) 2NO2(g) ΔH=-113.0 kJ·mol-1
2NO2(g) ΔH=-113.0 kJ·mol-1
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的ΔH= kJ·mol-1。
SO3(g)+NO(g)的ΔH= kJ·mol-1。
一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
a.体系压强保持不变
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变
d.每消耗1 mol SO3的同时生成1 molNO2
测得上述反应平衡时NO2与SO2体积比为1:6,则平衡常数K= 。
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g) CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如下图所示。该反应ΔH 0(填“>”或“ <”)
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如下图所示。该反应ΔH 0(填“>”或“ <”) 。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是 。
。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是 。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com