
 实验室用少量的溴和足量的乙醇、浓硫酸制备1,2-二溴乙烷的装置如图所示,其中可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚.
实验室用少量的溴和足量的乙醇、浓硫酸制备1,2-二溴乙烷的装置如图所示,其中可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚.| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | 一l30 | 9 | -1l6 |
分析 用少量的溴和足量的乙醇、浓硫酸制备1,2-二溴乙烷,装置A中是浓硫酸、乙醇迅速加热到170°C,反应生成乙烯,乙烯中含有二氧化硫、二氧化碳、水蒸气,1,2-二溴乙烷熔点为9℃,冷却容易析出晶体,堵塞玻璃导管,B为安全瓶,可以防止倒吸,根据E中内外液面高低变化,可以判断是否发生堵塞,装置C浓硫酸具有强氧化性,将乙醇氧化成二氧化碳,自身被还原成二氧化硫,二氧化碳;生成的酸性气体为SO2、CO2可以和氢氧化钠反应,装置D是发生的反应是乙烯与溴发生加成反应生成1,2-二溴乙烷,1,2-二溴乙烷的凝固点较低(9℃),反应过程中应用冷水冷却装置D得到1,2-二溴乙烷,
(1)三颈烧瓶A中发生反应是乙醇在浓硫酸的作用下加热到170℃产生乙烯;实验目的制备少量1,2-二溴乙烷,D是发生的反应是乙烯与溴发生加成反应生成1,2-二溴乙烷;
(2)乙醇在浓硫酸140℃的条件下,发生分子内脱水,生成乙醚;
(3)浓硫酸具有强氧化性,可能氧化乙醇中的碳,反应生成二氧化硫、二氧化碳等气体是酸性氧化物,和碱溶液发生反应被吸收;
(4)根据1,2-二溴乙烷和水的密度相对大小分析,1,2-二溴乙烷的密度大于水;
(5)Br2可以和氢氧化钠发生氧化还原反应;
(6)利用1,2-二溴乙烷与乙醚的沸点不同,控制温度不同通过蒸馏的方法分离;
(7)溴易挥发,该反应放热,溴易挥发,产品1,2-二溴乙烷的熔点(凝固点)低,冷凝变化为固体;
解答 解:(1)三颈烧瓶A中发生反应是乙醇在浓硫酸的作用下发生分子内脱水制取乙烯,乙醇发生了消去反应,反应方程式为:C2H5OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O,乙烯含有不饱和键C=C双键,能卤素单质发生加成反应,D中乙烯和溴加成生成1,2-二溴乙烷,反应为:CH2=CH2+Br-Br→CH2Br-CH2Br,
故答案为:C2H5OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O、CH2=CH2+Br2→CH2BrCH2Br;
(2)乙醇在浓硫酸140℃的条件下,发生分子内脱水,生成乙醚,
故答案为:d;
(3)浓硫酸具有强氧化性,将乙醇氧化成二氧化碳,自身被还原成二氧化硫,二氧化碳、二氧化硫能和氢氧化钠溶液反应,
故答案为:c;
(4)1,2-二溴乙烷和水不互溶,1,2-二溴乙烷密度比水大,
故答案为:下;
(5)常温下Br2和氢氧化钠发生反应:2NaOH+Br2═NaBr+NaBrO+H2O,
故答案为:b;
(6)1,2-二溴乙烷与乙醚的沸点不同,两者均为有机物,互溶,用蒸馏的方法将它们分离,
故答案为:蒸馏;
(7)溴在常温下,易挥发,乙烯与溴反应时放热,溴更易挥发,冷却可避免溴的大量挥发,但1,2-二溴乙烷的凝固点9℃较低,不能过度冷却,
故答案为:乙烯与溴反应时放热,冷却可避免溴的大量挥发;1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使气路堵塞.
点评 本题题较为综合,主要考查了乙醇制备1,2-二溴乙烷,掌握相关物质的基本化学性质,是解答本题的关键,平时须注意积累相关反应知识,难度中等.


 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 空石英管质量 m0/g | 石英管与钙的质量 m1/g | 石英管与产物的质量 m2/g |
| 14.800 | 15.080 | 15.150 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
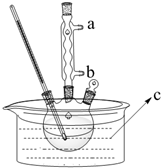 正丁醚(CH3CH2CH2CH2OCH2CH2CH2CH3)是一种化工原料,常温下为无色液体,不溶于水,沸点为142.4℃,密度比水小.某实验小组利用如下装置来合成正丁醚(其它装置均略去),发生的主要反应为:
正丁醚(CH3CH2CH2CH2OCH2CH2CH2CH3)是一种化工原料,常温下为无色液体,不溶于水,沸点为142.4℃,密度比水小.某实验小组利用如下装置来合成正丁醚(其它装置均略去),发生的主要反应为:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与Al反应放出氢气的溶液中:Na+、H+、NH4+、NO3- | |
| B. | 在c(H+)=1.0×10-13,mol/L的溶液中:Na+、K+、AlO2-、CO32- | |
| C. | 澄清透明的溶液中:Fe3+、Mg2+、NO3-、S2- | |
| D. | 在pH=1的溶液中:NH4+、K+、ClO-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ClO2气体是一种在水处理等方面有广泛应用的高效安全消毒剂.我国从2 000年起逐步用ClO2代替氯气对饮用水进行消毒.
ClO2气体是一种在水处理等方面有广泛应用的高效安全消毒剂.我国从2 000年起逐步用ClO2代替氯气对饮用水进行消毒.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com