
原电池是将化学能转变成电能的装置。某铜锌稀硫酸原电池中,电子由A极流出经导线流入B极,如图所示:
(1)A极金属是 ,该极为 极(填“正”或“负”),电极反应式为 ;B极金属是 ,该极为 极(填“正”或“负”),电极反应式为 ,该极可观察到的实验现象是 。
(2)若有0.1mol电子转移,则生成氢气在标准状况的体积为 L,溶解锌的质量为 g。

科目:高中化学 来源: 题型:
分子式为C10H20O2 的有机物,在酸性条件下水解生成有机物C和D,且C在一定条件下可转化为D, 则A的可能结构有
A.2种 B.3种 C.4种 D.5种
查看答案和解析>>
科目:高中化学 来源: 题型:
pH=1的两种酸溶液A、B各1 mL,分别加水稀释到1 000 mL,其pH与溶液体积(V)的关系如图所示,下列说法不正确的是 ( )
A.A、B两种酸溶液的物质的量浓度一定相等
B.稀释后,A酸溶液的酸性比B酸溶液的酸性弱
C.若a=4,则A是强酸,B是弱酸
D.若1<a<4,则A、B都是弱酸

查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式中书写正确的是
A.过氧化钠与水反应:2Na2O2+2H2O=4Na++4OH-+O2↑
B.用氢氧化钡溶液中和硫酸溶液:Ba2++OH-+H++SO42-=H2O+BaSO4↓
C.金属钠与水反应:Na +2H2O=Na++2OH-+H2↑
D.在澄清石灰水中通入过量的CO2:Ca2++2OH-+2CO2=Ca(HCO3)2
查看答案和解析>>
科目:高中化学 来源: 题型:
 下列化学用语表达错误的是 ( )
下列化学用语表达错误的是 ( )
A.原子核内有18个中子的氯原子:  B.NH4Br的电子式:
B.NH4Br的电子式:
 C.Mg的原子结构示意图为: D.丙烯的结构简式:CH3CH=CH2
C.Mg的原子结构示意图为: D.丙烯的结构简式:CH3CH=CH2
查看答案和解析>>
科目:高中化学 来源: 题型:
洋蓟素是一种新结构类型的抗乙型肝炎病毒和抗艾滋病病毒的化合物,其结构如下图所示,有关洋蓟素的说法正确的是( )
A.分子中含有4个手性碳原子
B.不能与氯化铁溶液发生显色反应
C.能发生酯化反应但不能发生水解反应
D.1mol洋蓟素最多可与11molNaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
二茂铁[(C5H5)2Fe] 分子是一种金属有机配合物,是燃料油的添加剂,用以提高燃烧的效率和去烟,可作为导弹和卫星的涂料。它的结构如右图所示,下列说法正确的是( )
 A.二茂铁中Fe2+与环戊二烯离子(C5H5-)之间为离子键
A.二茂铁中Fe2+与环戊二烯离子(C5H5-)之间为离子键
B.1mol环戊二烯(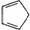 )中含有σ键的数目为5NA
)中含有σ键的数目为5NA
C.分子中存在π键
D.Fe2+的电子排布式为1s22s22p63s23p63d44s2
查看答案和解析>>
科目:高中化学 来源: 题型:
随着世界工业经济的发展、人口的剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视。
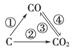
(1)右图为C及其氧化物的变化关系图,若①变化是置换反应,则其化学方程式可为______________________________________;
图中变化过程哪些是吸热反应________(填序号)。
(2)甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上可用如下方法合成甲醇:
方法一 CO(g)+2H2(g)CH3OH(g)
方法二 CO2(g)+3H2(g)CH3OH(g)+H2O(g)
在25℃、101 kPa下,1克甲醇完全燃烧放热22.68 kJ,写出甲醇燃烧的热化学方程式:_____________________________________________;
某火力发电厂CO2的年度排放量是2 200万吨,若将此CO2完全转化为甲醇,则理论上由此获得的甲醇完全燃烧放热约是________kJ(保留三位有效数字)。
(3)金属钛冶炼过程中其中一步反应是将原料金红石转化:TiO2(金红石)+2C+2Cl2高温,TiCl4+2CO 已知:C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1
2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ·mol-1
TiO2(s)+2Cl2(g)===TiCl4(s)+O2(g) ΔH=+141 kJ·mol-1
则TiO2(s)+2Cl2(g)+2C(s)===TiCl4(s)+2CO(g)的ΔH=________。
(4)臭氧可用于净化空气,饮用水消毒,处理工业废物和作为漂白剂。臭氧几乎可与除铂、金、铱、氟以外的所有单质反应。如:
6Ag(s)+O3(g)===3Ag2O(s) ΔH=-235.8 kJ·mol-1,
已知:2Ag2O(s)===4Ag(s)+O2(g)
ΔH=+62.2 kJ·mol-1,
则O3转化为O2的热化学方程式为_________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com