
| A.HClO4、H2SO4、H3PO4的酸性由强到弱 | B.HF、HCl、HBr、Hl的稳定性依次增强 |
| C.金属的熔点和沸点都很高 | D.H2O是一种非常稳定的化合物,这是由于氢键所致 |
 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源:不详 题型:单选题

| A.若它们均为金属元素,则X与氧元素组成的物质有多种 |
| B.若它们的原子最外层电子数之和为11,则它们均为非金属元素 |
| C.Z单质一定不能置换出Y单质。 |
| D.Z元素的最高化合价一定等于Y元素 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
| X | 578 | 1817 | 2745 | 11578 |
| Y | 738 | 1451 | 7733 | 10540 |
| Z | 496 | 4562 | 6912 | 9543 |
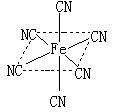
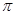 键数目为 ;
键数目为 ;查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Mg、Al、Si | B.Li、Be、Mg | C.N、O、S | D.P、S、O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.同周期主族元素的原子序数越大越易失电子 |
| B.同周期主族元素的原子序数越大半径越大 |
| C.同主族元素的原子序数越大非金属性越强 |
| D.同主族元素的原子序数越大金属性越强 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 2 | | | | c | | d | |
| 3 | a | b | | | | e | f |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com