
硫酸工业中SO2转化为SO3是重要的反应之一,在一定压强和催化剂作用下在2L密闭容器中充入0.8molSO2和2molO2发生反应:2SO2(g)+O2(g)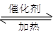 2SO3(g),SO2的转化率随温度的变化如下表所示:
2SO3(g),SO2的转化率随温度的变化如下表所示:
温度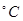 | 450 | 475 | 500 | 525 | 550 | 575 | 600 | 650 |
| SO2的转化率% | 97.5 | 95.8 | 95.8 | 93.5 | 90.50 | 85.6 | 80.0 | 73.7 |
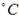 .③此温度下的平衡常数为 (可用分数表示).
.③此温度下的平衡常数为 (可用分数表示).(共10分)(1)(1分)< (2)(2分)A C F
(3)(7分)①0.08mol·L-1·min-1②600 ③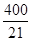 L·mol-1
L·mol-1
④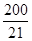 L·mol-1 正
L·mol-1 正
解析试题分析:(1)由表可知温度越高SO2的转化率越低,故总反应为放热反应,即△H<0。
(2)A.对于反应前后体积变化的反应,容器内压强不再发生变化,说明反应达到平衡状态,故A正确;
B.容器中气体的密度=m/V,反应前后质量守恒,反应在体积不变的容器中进行,所以气体的密度始终不变,故B错误;
C.达到平衡状态时,正逆反应速率相等,各物质的浓度不再改变,反应混合物中,SO3的质量分数不再改变,故C正确;
D.浓度相等不能判读反应达到化学平衡状态,故D错;
E.化学反应中转化的物质的量之比等于化学计量数之比,不能作为判断是否达到化学平衡的依据,故E错误;
F. v正(SO3): v逆(O2)=2:1,表明正逆反应速率相等是平衡状态,故F正确。
(3)①? C(SO2)=(0.8mol/2L)-0.08mol·L-1=0.32mol·L-1, v(SO2)=? C(SO2)/?t=(0.32mol·L-1)/2min="0.16" mol·L-1·min-1,根据化学反应速率之比等于化学计量数之比,故v(O2)= v(SO2)/2=0.08mol·L-1·min-1。
②由①可知? C(SO2)=0.32mol·L-1,故w(SO2)="[(0.32" mol·L-1)*100%]/( 0.8mol/2L)=80.0%,对照表中数据可知温度为600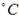 。
。
③K=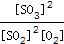 =(0.32mol·L-1)2/[(0.08mol·L-1)2*0.84 mol·L-1]=
=(0.32mol·L-1)2/[(0.08mol·L-1)2*0.84 mol·L-1]= 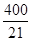 L·mol-1。
L·mol-1。
考点:化学平衡的计算 化学反应速率的影响因素
点评:本题主要考查化学平衡的计算,题目难度不大,注意三段式计算方法的运用。


 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 催化剂 |
压强 SO2的 转化率 温度 |
1×105 Pa | 5×105 Pa | 10×105 Pa | 50×105 Pa | 100×105 Pa |
| 450℃ | 97.5% | 98.9% | 99.2% | 99.6% | 99.7% |
| 550℃ | 85.6% | 92.9% | 94.9% | 97.7% | 98.3% |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
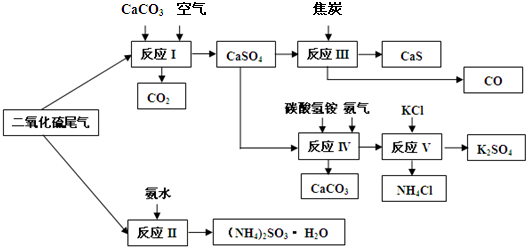
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com