

分析 烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备绿矾,为了减少引入新杂质,所以用硫酸溶解并通入足量氧气,反应后过滤得到滤渣M和溶液N,滤渣M中含硫,灼烧后会产生二氧化硫,溶液N中主要溶质为硫酸铁,加入足量的铁粉反应生成硫酸亚铁,过滤除去多余的铁粉,得到硫酸亚铁溶液,将硫酸亚铁溶液蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到绿矾,
(1)本实验要制备绿矾,为了不引入新杂质,要用硫酸溶解;
(2)过程?灼烧时产生的气体为SO2,具有还原性和漂白性及酸性氧化物的通性;
(3)根据流程分析可知,溶液N中主要溶质为硫酸铁,要制得绿矾要加铁粉,检验亚铁离子可以用KSCN溶液及氧化剂,看溶液颜色的变化;
(4)从硫酸亚铁溶液中得到绿矾,要将硫酸亚铁溶液蒸发浓缩、冷却结晶、过滤、洗涤、干燥;
(5)①高锰酸钾有强氧化性,应用酸式滴定管,根据电子得失守恒有关系式KMnO4~5FeSO4•7H2O,利用高锰酸钾的物质的量可以计算出FeSO4•7H2O的物质的量,进而确定质量分数;
②若在a步操作中,进行定容时仰视刻度线定容,则所得样品溶液浓度偏小,消耗的高锰酸钾的体积也会偏小,据此答题.
解答 解:烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备绿矾,为了减少引入新杂质,所以用硫酸溶解并通入足量氧气,反应后过滤得到滤渣M和溶液N,滤渣M中含硫,灼烧后会产生二氧化硫,溶液N中主要溶质为硫酸铁,加入足量的铁粉反应生成硫酸亚铁,过滤除去多余的铁粉,得到硫酸亚铁溶液,将硫酸亚铁溶液蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到绿矾,
(1)本实验要制备绿矾,为了不引入新杂质,要用硫酸溶解,
故答案为:硫酸;
(2)过程?灼烧时产生的气体为SO2,具有还原性和漂白性及酸性氧化物的通性,能使品红褪色,能与酸性KMnO4溶液发生氧化还原反应而使其褪色,能与碱反应使红色的酚酞试液褪色,不能使紫色石蕊溶液褪色,故选B;
(3)根据流程分析可知,溶液N中主要溶质为硫酸铁,要制得绿矾要加铁粉,反应的离子方程式为 Fe+2Fe3+=3 Fe2+,检验亚铁离子的方法是取待测液于试管中,滴入几滴KSCN,无明显现象,滴入双氧水或氯水,溶液变血红色,则说明溶液中含有亚铁离子,
故答案为:铁粉; Fe+2Fe3+=3 Fe2+;取待测液于试管中,滴入几滴KSCN,无明显现象,滴入双氧水或氯水,溶液变血红色,则说明溶液中含有亚铁离子;
(4)从硫酸亚铁溶液中得到绿矾,要将硫酸亚铁溶液蒸发浓缩、冷却结晶、过滤、洗涤、干燥,
故答案为:冷却结晶、洗涤;
(5)①高锰酸钾有强氧化性,应用酸式滴定管,高锰酸钾的物质的量为0.01mol•L-1×0.04L=0.0004mol,根据电子得失守恒有关系式KMnO4~5FeSO4•7H2O,则6.0g产品中含有FeSO4•7H2O的质量0.0004mol×$\frac{250}{25}$×5×278g/mol=5.56g,所以FeSO4•7H2O的质量分数为$\frac{5.56g}{6g}$×100%=92.7%,
故答案为:酸式;92.7%;
②若在a步操作中,进行定容时仰视刻度线定容,则所得样品溶液浓度偏小,消耗的高锰酸钾的体积也会偏小,根据①的计算可知测得的产品中FeSO4•7H2O的质量分数偏小,
故答案为:偏小.
点评 本题考查较为综合,涉及物质含量的测定、制备实验方案的设计等知识,题目难度中等,注意常见化学实验操作方法及实验误差分析方法.


 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:解答题
 、
、 .
. (写出一种即可).
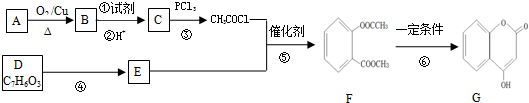
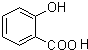
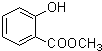
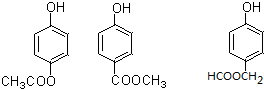
(写出一种即可).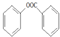 )是一种重要的有机合成中间体,参照化合物G的上述合成路线,设计一条以苯酚和甲苯为起始原料制备苯甲酸苯酚酯的合成路线
)是一种重要的有机合成中间体,参照化合物G的上述合成路线,设计一条以苯酚和甲苯为起始原料制备苯甲酸苯酚酯的合成路线 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg2+ Na+ OH- | B. | Al3+ NO3- Cl- | ||
| C. | K+ H+ HCO3- | D. | Mg2+ Ca2+ SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有②③⑤ | B. | 只有 ①②③ | C. | 除④、⑤外均正确 | D. | 全部正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 干冰汽化需吸收大量的热,这个变化是吸热反应 | |
| B. | 浓硫酸溶于水会放出大量热,这属于放热反应 | |
| C. | 用氢氧焰可以加热软化玻璃制玻璃器皿,这利用了氢气和氧气化合时放出的热量 | |
| D. | 木炭需加热到一定温度时才燃烧,所以木炭燃烧是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
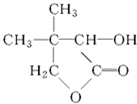 G的合成路线如图:
G的合成路线如图: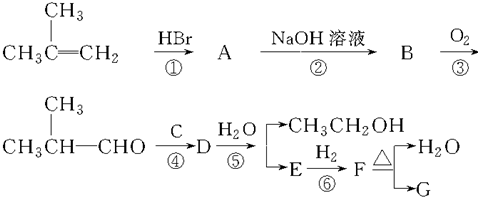
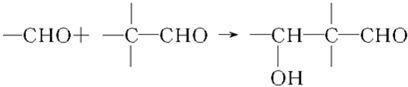
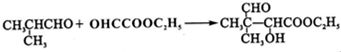
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
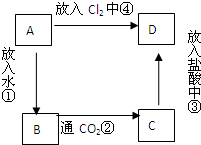 物质A是由A元素组成的单质,将其在酒精灯火焰上灼烧,火焰为黄色,B,C,D是含有A元素的三种不同化合物,A、B、C、D按图关系进行转化:
物质A是由A元素组成的单质,将其在酒精灯火焰上灼烧,火焰为黄色,B,C,D是含有A元素的三种不同化合物,A、B、C、D按图关系进行转化:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
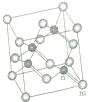 第ⅤA族的氮、磷、砷(As)等元素在化合物中常表现出多种氧化态,含第ⅤA族元素的化合物在研究和生产中有许多重要用途.
第ⅤA族的氮、磷、砷(As)等元素在化合物中常表现出多种氧化态,含第ⅤA族元素的化合物在研究和生产中有许多重要用途.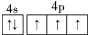 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com