
【题目】下列物质中,分子的立体结构与水分子相似的是 ( )
A.CO2B.H2SC.PCl3D.SiCl4
【答案】B
【解析】
H2O中O原子上孤电子对数为![]() =2,σ键电子对数为2,则H2O分子的立体构型为V形;分析各分子的立体构型对比作答。
=2,σ键电子对数为2,则H2O分子的立体构型为V形;分析各分子的立体构型对比作答。
A.CO2中C原子上孤电子对数为![]() =0,σ键电子对数为2,则CO2分子的立体构型为直线形,与水分子立体构型不同,A不合题意;
=0,σ键电子对数为2,则CO2分子的立体构型为直线形,与水分子立体构型不同,A不合题意;
B.H2S中S原子上孤电子对数为![]() =2,σ键电子对数为2,则H2S分子的立体构型为V形,与水分子立体构型相似,B符合题意;
=2,σ键电子对数为2,则H2S分子的立体构型为V形,与水分子立体构型相似,B符合题意;
C.PCl3中P原子上孤电子对数为![]() =1,σ键电子对数为3,则PCl3分子的立体构型为三角锥形,与水分子立体构型不同,C不合题意;
=1,σ键电子对数为3,则PCl3分子的立体构型为三角锥形,与水分子立体构型不同,C不合题意;
D.SiCl4中Si原子上孤电子对数为![]() =0,σ键电子对数为4,则SiCl4分子的立体构型为正四面体形,与水分子立体构型不同,D不合题意;
=0,σ键电子对数为4,则SiCl4分子的立体构型为正四面体形,与水分子立体构型不同,D不合题意;
故选B。


科目:高中化学 来源: 题型:
【题目】如图是元素周期表中短周期的一部分,若A元素原子的最外层电子数比次外层电子数少3,则下列说法正确的是( )
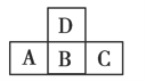
A.四种元素都是非金属元素
B.B与D之间能形成三种常见的化合物
C.A与C的原子序数之和跟B与D的原子序数之和相等
D.四种元素形成的单质在常温下都是气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】GaAs 晶体的熔点很高,硬度很大,密度为ρ gcm-3,Ga和 As的摩尔质量分别为 MGa gmol-1 和 MAsgmol-1,原子半径分别为 rGa pm 和 rAs pm,阿伏加德罗常数值为 NA,其晶胞结构如图所示,下列说法错误的是
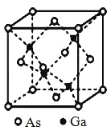
A.该晶体为共价晶体
B.该晶体中 Ga 和 As 均无孤对电子,Ga 和 As 的配位数均为 4
C.原子的体积占晶胞体积的百分率为![]()
D.所有原子均满足 8 电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是CsCl晶体的晶胞(晶体中最小的重复单元)已知晶体中2个最近的Cs+核间距离为acm,氯化铯的式量为M,NA为阿伏加德罗常数,则CsCl晶体的密度为(单位:g/cm)
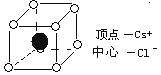 ( )
( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分。表中所列的字母分别代表某一化学元素。
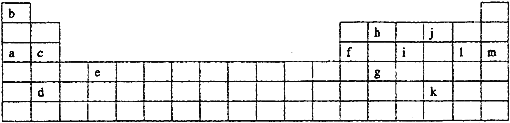
如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去。核外电子离开该原子或离子所需要的能量主要受两大因素的影响:
A.原子核对核外电子的吸引力 B.形成稳定结构的倾向
下表是一些气态原子失去核外不同电子所需的能量(kJ·mol-1):
锂 | X | Y | |
失去第一个电子 | 519 | 502 | 580 |
失去第二个电子 | 7296 | 4570 | 1820 |
失去第三个电子 | 11799 | 6920 | 2750 |
失去第四个电子 | 9550 | 11600 |
(1)通过上述信息和表中的数据分析为什么锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量_______________________________;
(2)表中X可能为以上13种元素中的______(填写字母)元素。用元素符号表示X和j形成化合物的化学式________;
(3)Y是周期表中_______族元素;
(4)以上13种元素中,_____(填写字母)元素原子失去核外第一个电子需要的能量最多。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出(1)~(4)原子的电子排布式,用价层电子对互斥模型推测(5)~(8)分子的空间构型。
(1)Li _______________;(2)K _______________;(3)Mg ________________;(4)Cl ______________;(5)CO2_______________;(6)SO2______________;(7)NH3_________________;(8)CH4_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在离子晶体中,阴阳离子按一定规律在空间排列,如图(1)所示即是NaCl的晶体结构,这两种离子在空间三个互相垂直的方向上都是等距离排列的。
(1)在晶体中,每个Na+离子周围与它最接近的、且距离相等的Cl-共有_________个;
每个Na+离子周围与它最接近的、且距离相等的Na+共有__________个。而Na+离子数目与Cl-离子数目之比为______________。
在离子晶体中,阴阳离子具有球对称的电子云。它们可以被看成是不等径的刚性圆球,并彼此相切(如图⑵所示)。离子键的键长是相邻阴阳离子的半径之和(如图⑶所示),已知a为常数。

试回答下列问题:
(2)NaCl晶体中离子键的键长为______________________。Na+离子半径与Cl-离子半径比r+/r- =____________。(已知 √2=1.414 , √3=1.732, √5=2.236)
(3)NaCl晶体中不存在分子,但在温度达到1413℃时,NaCl晶体形成气体,并以分子形式存在,现有29.25gNaCl晶体,强热使温度达到1450℃,测得气体体积为5.6L(已折算为标准状况),则此时氯化钠气体的分子式为_______________________。
(4)纳米材料的表面原子占总原子数的比例极大,这是它具有许多特殊性质的原因,假设某氯化钠纳米颗粒的大小和形状恰好等于氯化钠晶胞的大小和形状,则这种纳米颗粒的表面原子占总原子数的百分数为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】改变0.1 mol·L-1二元弱酸H2A溶液的pH,溶液中的H2A、HA-、A2-的物质的量分数δ(X)随pH的变化如图所示[已知![]() ]。下列叙述不正确的是( )
]。下列叙述不正确的是( )

A.NaHA溶液中,HA-的水解能力小于HA-的电离能力
B.lg[K2(H2A)]=-4.2
C.将等物质的量的NaHA和Na2A混合物溶于水,所得的溶液中α(HA-)=α(A2-)
D.0.1 mol·L1 NaHA溶液中:c(Na+)+c(A2)+c(H2A)+c(HA)=0.2 mol·L1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com