
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| 5n(NO)(mol) | 0.020 | 0.010 | 0.006 | 0.004 | 0.004 | 0.004 |
| 0.0082 |
| 0.0022×0.001 |
| 1 |
| 2 |
| 1 |
| 2 |
| 0.01mol/L-0.003mol/L |
| 2s |


 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:
| A、压强相同,体积相同的CO和H2 |
| B、相同温度下,1LH2和1LCO |
| C、质量相等,密度不等的N2和C2H4 |
| D、体积相等,密度不等的N2和CO |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、漂白粉是纯净物,漂白液是混合物 |
| B、漂白粉的有效成分是CaClO2 |
| C、工业上将氯气通入石灰乳中制取漂白粉 |
| D、漂白液的有效成分是Na2O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、由水电离的c(H+)=1×10-14mol?L-1的溶液中:Ca2+、K+、Cl-、HCO3- |
| B、甲基橙呈红色的溶液:NH4+、Ba2+、AlO2-、Cl- |
| C、在pH=0的溶液中,Na+、NO3-、SO32-、K+ |
| D、pH=12的溶液:K+、Na+、CH3COO-、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
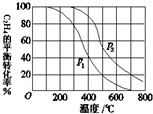 (1)乙醇是重要的有机化工原料,可由乙烯直接水合法生产.
(1)乙醇是重要的有机化工原料,可由乙烯直接水合法生产.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| (I) | (Ⅱ) | |
| A | 少量SO2通人Ba(OH)2溶液 | 过量SO2通入少量Ba(OH)2溶液 |
| B | 少量浓氨水滴入Al2(SO4)3溶液 | 少量Al2(SO4)3溶液滴入浓氨水 |
| C | 0.1molCl2通人含0.2molFeBr2的溶液 | 0.3molCl2通入0.2mol FeBr2溶液中 |
| D | 过量BaCl2溶液与少量Na2SO3溶液相混合 | 少量Ba(NO3)2溶液与过量MgSO4溶液相混合 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属铝有好的导热性,常用铝箔做包装材料 |
| B、Al2O3是两性氧化物,常用其作耐火材料 |
| C、Al(OH)3能与胃液中的盐酸反应,可用其制作中和胃酸的药物 |
| D、明矾能吸附水中的悬浮物,可用其作净水剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com