
【题目】苯甲酸乙酯(C9H10O2)稍有水果气味,用于配制香水香精和人造精油,大量用于食品工业中,也可用作有机合成中间体、溶剂等。其制备方法为:

已知:
颜色、状态 | 沸点(℃) | 密度(g·cm-3) | |
苯甲酸 | 无色、片状晶体 | 249 | 1.265 9 |
苯甲酸乙酯 | 无色澄清液体 | 212.6 | 1.05 |
乙醇 | 无色澄清液体 | 78.3 | 0.789 3 |
环己烷 | 无色澄清液体 | 80.8 | 0.731 8 |
*苯甲酸在100 ℃会迅速升华。
实验步骤如下:
a.在100 mL圆底烧瓶中加入12.20 g苯甲酸、25 mL乙醇(过量)、20 mL 环己烷,以及4 mL浓硫酸,混合均匀并加入沸石,按下图所示装好仪器,控制温度在65~70 ℃加热回流2 h。反应时环己烷—乙醇—水会形成“共沸物”(沸点62.6 ℃)蒸馏出来,再利用分水器不断分离除去反应生成的水,回流环己烷和乙醇。

b.反应结束,打开旋塞放出分水器中液体后,关闭旋塞。继续加热,至分水器中收集到的液体不再明显增加,停止加热。
c.将烧瓶内反应液倒入盛有适量水的烧杯中,加入饱和Na2CO3溶液。
d.用分液漏斗分出有机层,水层用25 mL乙醚萃取分液,然后合并至有机层。加入氯化钙,对粗产物进行蒸馏,低温蒸出乙醚后,继续升温,接收210~213 ℃的馏分。
e.检验合格,测得产品体积为12.86 mL。
回答下列问题:
(1)反应中浓硫酸的作用是:________________。步骤a中加入沸石作用:____________。温度在65~70 ℃加热的方法是:________________。
(2)仪器A的名称是:________________。该反应类型为______________。
(3)关于步骤d中的分液操作叙述正确的是________。
A.水溶液中加入乙醚,转移至分液漏斗中,塞上玻璃塞。将分液漏斗倒转过来,用力振摇
B.振摇几次后需打开分液漏斗下口的玻璃活塞放气
C.经几次振摇并放气后,手持分液漏斗静置待液体分层
D.放出液体时,需将玻璃塞上的凹槽对准漏斗口上的小孔
(4)上述实验中饱和碳酸钠溶液的作用是___________________。
(5)当达到该反应的限度,也即达到化学平衡状态。下列描述能说明该反应已达到化学平衡状态的有(填序号)_______________________。
①单位时间里,生成1mol苯甲酸乙酯,同时生成1mol水
②单位时间里,生成1mol苯甲酸乙酯,同时生成1mol乙醇
③单位时间里,消耗1mol乙醇,同时消耗1mol苯甲酸
④正反应的速率与逆反应的速率相等
⑤合物中各物质的浓度不再变化
⑥混合物中各物质的浓度相等
【答案】催化剂、吸水性 防止爆沸 水浴加热 球形冷凝管 酯化反应或取代反应, AD 吸收乙醇,中和苯甲酸,降低苯甲酸乙酯的溶解度 ②④⑤
【解析】
(1)浓硫酸作催化剂,且吸水,使反应正向移动;加入沸石防止爆沸,温度在100℃以内可以用水浴加热,受热更加均匀;
(2)有机物中,羧酸与醇类物质反应生成酯,属于酯化反应或取代反应;
(3)分流漏斗的使用方法,必须将水溶液中加入乙醚,转移至分液漏斗中,塞上玻璃塞,将分液漏斗倒转过来,用力振摇,而且放出液体时,需将玻璃塞上的凹槽对准漏斗口上的小孔,只有这样液体才能顺利流下;
(4)饱和碳酸钠溶液具有吸收乙醇,中和苯甲酸,降低苯甲酸乙酯的溶解度;
(5)当正逆反应速率相等时,反应达到平衡。
(1)在酯化反应中,浓硫酸具有催化和吸水的作用,加入沸石防止爆沸,温度在65~70 ℃加热的方法是水浴加热,故答案为:催化剂、吸水性;防止爆沸;水浴加热;
(2)仪器A的名称为球形冷凝管,该反应类型为酯化反应或取代反应,故答案为:球形冷凝管;酯化反应或取代反应;
(3)A.分液漏斗的使用方法,是在水溶液中加入乙醚,转移至分液漏斗中,塞上玻璃塞,将分液漏斗倒转过来,用力振摇,A正确;
B.振摇过程应该打开上口的玻璃塞放气,B错误;
C.分液漏斗要放到铁架台上静置,C错误;
D.放出液体时,需将玻璃塞上的凹槽对准漏斗口上的小孔,只有这样液体才能顺利流下,D正确;
故答案为:AD;
(4)饱和碳酸钠溶液具有吸收乙醇,中和苯甲酸,降低苯甲酸乙酯的溶解度,以便于分离的作用,故答案为:吸收乙醇,中和苯甲酸,降低苯甲酸乙酯的溶解度;
(5)①单位时间里,生成1mol苯甲酸乙酯,同时生成1mol水,都是正反应方向进行,不能说明反应达到平衡状态,①错误;
②单位时间里,生成1mol苯甲酸乙酯,同时生成1mol乙醇,说明正逆反应速率相等,能说明反应达到平衡状态,②正确;
③单位时间里,消耗1mol乙醇,同时消耗1mol苯甲酸,都是正反应方向进行,不能说明反应达到平衡状态,③错误;
④正反应的速率与逆反应的速率相等,能说明反应达到平衡状态,④正确;
⑤混合物中各物质的浓度不再变化,说明正逆反应速率相等,能说明反应达到平衡状态,⑤正确;
⑥混合物中各物质的浓度相等,不能说明反应达到平衡状态,⑥错误;故答案为:②④⑤。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示。下列说法错误的是
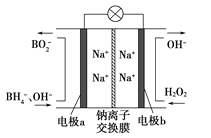
A. 电池放电时Na+从a极区移向b极区
B. 电极b采用MnO2,MnO2既作电极材料又有催化作用
C. 该电池的负极反应为:BH4-+8OH――8e-=BO2-+6H2O
D. 每消耗3molH2O2,转移的电子为3mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某芳香族化合物A的水溶液呈酸性,测得A分子中无酚羟基。A可发生下图所示转化,其中F为五元环状化合物;G可使溴的四氯化碳溶液褪色;F和G互为同分异构体;H和I都是医用高分子材料。

请回答:
(1)E中的官能团名称是羟基、 。
(2)③的反应类型是 。
(3)②的化学方程式是 。
(4)A与H的结构简式分别是 、 。
(5)D与足量X溶液反应后可得到C7H5O3Na,则X溶液中所含溶质的化学式是 。
(6)符合下列条件的G的同分异构体中有一种具有反式结构.该反式结构是 (用结构简式表示)。
①能发生水解反应
②分子中不含环状结构
③核磁共振氢谱显示分子中有4种不同化学环境的氢原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,10mL0.40molL-1H2O2溶液发生催化分解。不同时刻测得生成O2的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)( )
A.0~6min的平均反应速率:v(H2O2)≈3.3×10-2mol·L-1·min-1
B.6~10min的平均反应速率:v(H2O2)<3.3×10-2mol·L-1·min-1
C.反应至6min时,c(H2O2)=0.30mol·L-1
D.反应至6min时,H2O2分解了50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇:在容器为1L的密闭容器中充入1molCO2和3molH2 ,平衡时CO2的物质的量为0.25mol,CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。该反应进行过程中能量的变化(单位为kJ·mol-1)如图所示。
CH3OH(g)+H2O(g)。该反应进行过程中能量的变化(单位为kJ·mol-1)如图所示。

请回答下列问题:
(1)观察图象可知上述反应过程中,断裂反应物中的化学键吸收的总能量______(填“大于”“小于”或“等于”)形成生成物中的化学键释放的总能量。
(2)甲醇的结构类似于乙醇,试写出甲醇的结构式:__________。甲醇分子中的化学键类型是________(填“离子键”或“共价键”)。
(3)科研人员开发出一种新型甲醇燃料电池。其电解质溶液是KOH溶液,在该电池的负极发生反应的物质是__________,发生的是__________(填"氧化"或"还原")反应。
(4)欲使合成甲醇的化学反应速率加快,请写出两条措施:___________________
(5)平衡时H2的转化率为__________平衡时混合气体中CH3OH(g)的体积分数为__________。
(6)下列事实能表明该反应已达平衡状态的是(_______)(填序号)
A.CO2(g)的浓度不再发生变化
B.单位时间内消耗1mol CO2的同时生成3mol H2
C.在一个绝热的容器中,混合物的温度不再发生变化
D.在一个容积固定的容器内,压强不再发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学方程式书写正确的是( )
A.乙酸乙酯的制备:CH3COOH + CH3CH218OH![]() CH3COOCH2CH3 + H218O
CH3COOCH2CH3 + H218O
B.乙醛与新制氢氧化铜悬浊液共热:CH3CHO + 2Cu(OH)2 + NaOH ![]() CH3COONa + Cu2O↓+ 3H2O
CH3COONa + Cu2O↓+ 3H2O
C.苯酚钠溶液中通入少量二氧化碳:2![]() + CO2 + H2O
+ CO2 + H2O ![]() 2
2![]() + Na2CO3
+ Na2CO3
D.用铁作电极电解饱和氯化钠溶液:2NaCl + 2H2O![]() 2NaOH + H2↑+ Cl2↑
2NaOH + H2↑+ Cl2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在金属Pt、Cu和铱(Ir)的催化作用下,密闭容器中的H2可高效转化酸性溶液中的硝态氮(NO3)以达到消除污染的目的。其工作原理的示意图如下:

下列说法不正确的是
A. Ir的表面发生反应:H2 + N2O == N2 + H2O
B. 导电基体上的负极反应:H2-2e == 2H+
C. 若导电基体上只有单原子铜,也能消除含氮污染物
D. 若导电基体上的Pt颗粒增多,不利于降低溶液中的含氮量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今年为门捷列夫发现元素周期律150周年。门捷列夫预言了很多未知元素,锗是其中一种,工业上用精硫锗矿(主要成分为GeS2)制取高纯度锗,其工艺流程如图所示:
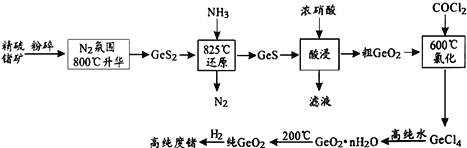
(1)开始将精硫锗矿粉碎的目的是_______。工艺流程中COCl2分子中各原子均达到8电子稳定结构,其结构式为_______。
(2)酸浸时温度不能过高的原因是______(用化学方程式表示)。
(3)GeCl4易水解生成GeO2·nH2O,此过程化学方程式为___________。温度对GeCl4水解率的影响如图所示,为提高水解率,实验时可采取的措施为______(填序号)。
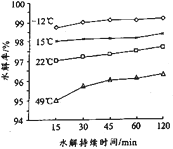
A.冰水溶 B.冰盐水浴 C.49℃水浴
(4)GeO2是锗酸(H2GeO3)的酸酐。请通过计算判断25℃时0.1mol·L—1的 NaHGeO2溶液pH________(填“>”=”或“<”)7,理由是__________。(已知25℃时,H2GeO2的![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为原子序数依次增大的短周期主族元素,其原子半径与最外层电子数的关系如下图1。E原子最外层上的电子数是D原子最外层电子数的4倍,D离子核外电子排布与C2-相同。

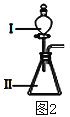
试回答:
(1)元素E在元素周期表中的位置是___________________。
(2)与元素D离子所含电子数和质子数均相同的微粒是________________。(用化学式作答,下同)
(3)B和E最高价氧化物对应的水化物,酸性较弱的_________________。若用上图2中装置验证这两种酸的酸性强弱,则在装置中加入的试剂分别为:Ⅰ___________,Ⅱ__________,观察到的实验现象是________________________。
(4)由以上五种元素组成的物质,其组成和结构信息如下表:
物质 | 组成和结构信息 |
a | 含有A、C、D的盐 |
b | C、D组成的化合物,且原子数之比为1∶1 |
c | 化学组成为AC2 |
①a含有的化学键有___________________________________;
②b与c反应的化学方程式为_________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com