
【题目】X和Y均为元素周期表前20号元素,X2-和Yˉ离子具有相同的电子层结构。下列正确的是:
A. 原子半径 X<YB. 离子半径X2->Yˉ
C. 质子数X>YD. 氢化物的稳定性H2X >HY
 天天向上一本好卷系列答案
天天向上一本好卷系列答案科目:高中化学 来源: 题型:
【题目】已知反应:① SO3+H2O = H2SO4 ② 3NO2+H2O = 2HNO3+NO ③ 2F 2+2H2O = 4HF+O2 ④ 2Na+2H2O = 2NaOH+H2↑ ⑤ 2Na2O2+2H2O = 4NaOH+O2↑ ⑥ SiO2+2NaOH = Na2SiO3+H2O
(1)上述反应中不属于氧化还原反应的有____________(填序号,下同);H2O被氧化的是_________,H2O被还原的是_________;属于氧化还原反应,但其中的H2O既不被氧化,又不被还原的是___________。
(2)写出⑤的离子方程式___________________________。
(3)用单线桥法标出④式中电子转移的方向和数目。2Na + 2H2O = 2NaOH + H2↑___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,甲池的总反应式为:N2H4+O2═N2+2H2O下列关于该电池工作时说法正确的是( ) 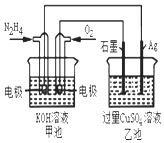
A.甲池中负极反应为:N2H4﹣4e﹣═N2+4H+
B.甲池溶液pH不变,乙池溶液pH减小
C.反应一段时间后,向乙池中加一定量CuO固体,能使CuSO4溶液恢复到原浓度
D.甲池中消耗2.24L O2 , 此时乙池中理论上最多产生12.8g固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白磷与氧可发生如下反应:P4+5O2═P4O10 . 已知断裂下列化学键需要吸收的能量分别为:P﹣P:a kJmol﹣1、P﹣O:b kJmol﹣1、P=O:c kJmol﹣1、O=O:d kJmol﹣1 . 根据图示的分子结构和有关数据估算该反应的△H,其中正确的是( ) 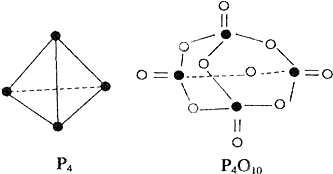
A.(6a+5d﹣4c﹣12b)kJmol﹣1
B.(4c+12b﹣6a﹣5d)kJmol﹣1
C.(4c+12b﹣4a﹣5d)kJmol﹣1
D.(4a+5d﹣4c﹣12b)kJmol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+B(g)C(g)+D(g)过程中的能量变化如图所示,回答下列问题.
(1)该反应是反应(填“吸热”、“放热”).
(2)当反应达到平衡时,升高温度,A的转化率 (填“增大”、“减小”、“不变”),原因是
(3)反应体系中加入催化剂对反应热是否有影响?(填“有”、“无”),原因是 .
(4)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1 , E2(填“增大”、“减小”、“不变”). 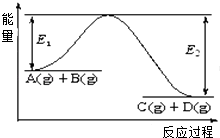
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( ) 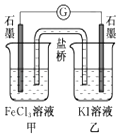
A.金属发生吸氧腐蚀时,被腐蚀的速率和氧气浓度无关
B.标准状况下,2.24LCCl4分子中共价键的数目为0.4×6.02×1023
C.控制适合的条件,将反应2Fe3++2I﹣═2Fe2++I2设计成如图所示的原电池.当电流汁读数为零后,在甲中溶入FeCl2固体,则乙中石墨电极为负极
D.向盛有2mL饱和H2S溶液的两支试管中分别滴加1滴浓度均为0.1mol/L的ZnSO4溶液和CuSO4溶液,有CuS生成而无ZnS生成,则Ksp(CuS)<Ksp(ZnS)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可制备硫及铁的化合物.
(1)冶炼铜的反应为:8CuFeS2+21O2=8Cu+4FeO+2Fe2O3+16SO2。若CuFeS2中Fe的化合价为+2,反应中被还原的元素是________(填元素符号).若反应中生成了标况下22.4L气体,转移的电子数目为________。
(2)上述冶炼过程产生大量酸性氧化物SO2,为大气污染物之一。下列处理方案中合理的是________(填代号).
a.高空排放 b.用浓硫酸氧化吸收制硫酸
c.用NaOH溶液吸收制Na2SO3 d.用氨水吸收制氮肥铵盐
(3)过二硫酸钾(K2S2O8)具有强氧化性,可将I-氧化为I2:S2O![]() +2I-=2SO
+2I-=2SO![]() +I2。通过改变反应途径,Fe3+、Fe2+均可催化上述反应.试用离子方程式表示Fe3+对上述反应催化的过程.________、________(不必配平)。
+I2。通过改变反应途径,Fe3+、Fe2+均可催化上述反应.试用离子方程式表示Fe3+对上述反应催化的过程.________、________(不必配平)。
(4)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3,方法为:
①用稀盐酸浸取炉渣,过滤.
②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3.
据以上信息回答下列问题:
a.除去Al3+的离子方程式是________.
b.选用提供的试剂,设计实验验证炉渣中含有FeO.
提供的试剂:稀盐酸 稀硫酸 KSCN溶液 KMnO4溶液 NaOH溶液 碘水 所选试剂为________.证明炉渣中含有FeO的实验现象为____________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com