
| A. | NaOH | B. | NaHCO3 | C. | NH4Cl | D. | CH3COONa |
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 16.51 g | B. | 23.82 g | C. | 24.84 g | D. | 17.02 g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入一定量C,平衡逆向移动 | |
| B. | 保持温度不变,容器容积压缩到原来的一半,物质B的浓度变为原来的1.8倍,则平衡正向移动 | |
| C. | 恒温恒压,再充入1mol氦气(不参与反应),A的转化率增大,则m<n | |
| D. | 恒温恒压,再加入2mol的A,气体的平均相对分子质量变为原来的2倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
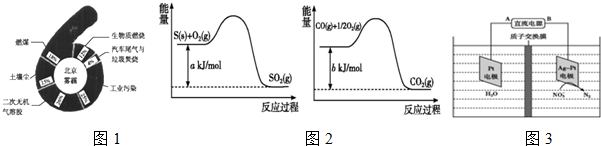
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | I->Fe2+>Cl->SO2 | B. | Cl->Fe2+>SO2>I- | ||
| C. | Fe2+>I->Cl->Cl->SO2 | D. | SO2>I->Fe2+>Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水是还原产物 | B. | Fe(OH)3发生还原反应 | ||
| C. | Cl2是氧化剂 | D. | 每生成1mol K2FeO4转移2mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
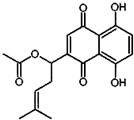 乙酰紫草素具有抗菌、抗炎、抗病毒、抗肿瘤等作用,它的结构简式如图所示,下列有关乙酰紫草素的说法正确的是( )
乙酰紫草素具有抗菌、抗炎、抗病毒、抗肿瘤等作用,它的结构简式如图所示,下列有关乙酰紫草素的说法正确的是( )| A. | 该分子中含有1个手性碳原子 | |
| B. | 能与FeCl3溶液发生显色反应 | |
| C. | 1mol 乙酰紫草素最多可与2molBr2反应 | |
| D. | 1mol乙酰紫草素最多可与2molNaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(SO42-)>c(NH4+)>c(Fe2+)>c(H+)>c(OH-) | B. | c(NH3•H2O)+c(NH4+)=0.2mol•L-1 | ||
| C. | 2c(SO42-)+c(OH-)=c(NH4+)+2c(Fe2+)+c(H+) | D. | c(H+)=c(OH-)+c(NH3•H2O) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com