
| A. | 氯化氢 | B. | 石墨 | C. | NaCl溶液 | D. | 蔗糖 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
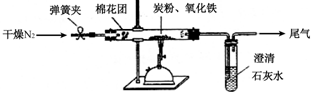
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 超级病菌NDM-l几乎对所有抗生素都具有抗药性,死亡率很高.为防止超级病菌的感染,要加强环境、个人的卫生和消毒,其中消毒剂常选用含氯消毒剂、双氧水、酒精等适 宜的物质 | |
| B. | “辽宁舰”上用于舰载机降落拦阻索的特种钢缆,属于新型无机非金属材料 | |
| C. | 白酒中混有少量塑化剂,少量饮用对人体无害,可通过过滤方法除去 | |
| D. | 绿色化学的核心是应用化学原理对环境污染进行治理 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
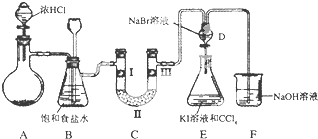
| a | b | c | d | |
| Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 碱石灰 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 形成较多的白色沉淀 | |
| B. | 排除SO42-以外的其它阴离子及Ag+的干扰 | |
| C. | 形成的沉淀纯度更高 | |
| D. | 排除Ba2+以外的其它阳离子的干扰 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①>② | B. | ①<② | C. | ①=② | D. | 不能确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
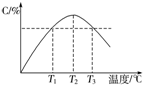
| A. | 0~5 min,C物质的平均反应速率为0.04 mol•L-1•min-1 | |
| B. | 图中温度T1时的正反应速率等于温度T3时的正反应速率 | |
| C. | 该反应温度T2时的平衡常数大于温度T3时的平衡常数 | |
| D. | 图中T2时,若只增大压强,则正、逆反应速率不改变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com