
| A.植物油和自来水(蒸馏) | B.水溶液中的食盐和碘(分液) |
| C.CaCO3和CaCl2(溶解、过滤、蒸发) | D.自来水中的杂质(萃取) |
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

| 操 作 | 现象及结论 |
| 基于方案一: | |
| 基于方案二: | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

| A.酒精 | B.CCl4 | C.苯 | D.醋酸 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.向最后一次洗涤液中滴加碳酸钠溶液可检验沉淀是否洗涤干净 |
| B.上述变化过程中包括了分解、化合、复分解三种反应类型 |
| C.步骤⑤也可以采用电解该盐水溶液的方法 |
| D.为节省原料、减少污染,在提取镁的工业流程中使用了物质循环的过程 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①④③② | B.④③①② | C.④②③① | D.②①③④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.由于碘在酒精中的溶解度大,所以可用酒精把碘水中的碘萃取出来 |
| B.水的沸点为100oC,酒精的沸点为78.5oC,所以可用加热蒸馏方法,使含水的酒精变为无水酒精 |
| C.四氯化碳和水混合后,可用分液的方法来分离 |
| D.NaCl溶解度随温度下降而减小,所以用冷却法从热的含少量KNO3的NaCl溶液中分离得到纯净的NaCl |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.硝酸钠、氢氧化钠 | B.氧化铜、二氧化锰 |
| C.氯化钾、二氧化锰 | D.硫酸铜、氢氧化钙 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
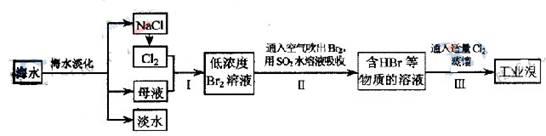
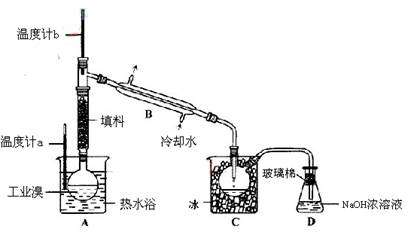
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com