
����Ŀ��ij���dz��Ը���Ϊԭ�����ǣ�ͬʱ�õ������ĸ��������Ը����������ۺ����ò�����������ۺ�Ч�棬���һ��ܷ�ֹ������Ⱦ�������������£�
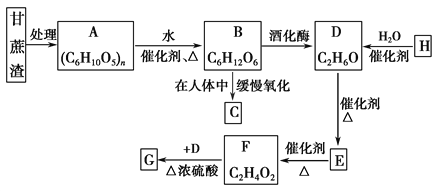
��֪ʯ���ѽ��ѳ�Ϊ����H����Ҫ������E����Һ�ܷ���������Ӧ��G�Ǿ�����ζ��Һ�壬�Իش��������⡣
(1) D�ĽṹʽΪ_______________________________________��
(2) H��D�Ļ�ѧ��Ӧ����Ϊ______________________________��
(3) F��G�ķ�Ӧװ����ͼ��ʾ��
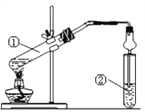
a.ͼ�е������θ���ܵ�����_____________________________��
b.�Թܢ��м��б���Na2CO3��Һ���������ǣ� ____________________��
c. ��184 g D��90 g F��Ӧ������106 g G����÷�Ӧ�IJ���Ϊ___________��
����֪��![]() ��
��
(4) D��E�Ļ�ѧ����ʽ��________________________��
(5) д��H�����Ӿ۷�Ӧ�ķ���ʽ��_________________��
(6) д��������������Ҫ������ʵĽṹ��ʽ��______________________��
����CH3CH2COOH��Ϊͬ���칹�� ����G������ͬ������
���𰸡�  �ӳ� .������ �ܽ��Ҵ����к����ᣬ�������������ܽ�� 80.3% 2CH3CH2OH + O2
�ӳ� .������ �ܽ��Ҵ����к����ᣬ�������������ܽ�� 80.3% 2CH3CH2OH + O2![]() 2CH3CHO +2H2O
2CH3CHO +2H2O ![]() HCOOC2H5 CH3COOCH3
HCOOC2H5 CH3COOCH3
������������������֮��õ���ά�أ���ά��ˮ������ղ���Ϊ�����ǣ�����A����ά�أ�B�������ǣ��������ھƻ�ø�������·�Ӧ�����Ҵ�����D���Ҵ���D��������������EΪCH3CHO��E��һ������������Ӧ����FΪCH3COOH��F��D����������Ӧ����GΪCH3COOCH2CH3�������������������������õ�������̼��ˮ��H��ˮ��Ӧ�ﵽ�Ҵ�����HΪCH2=CH2��
(1) D���Ҵ����ṹʽΪ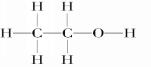 ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��
(2) ��ϩ��ˮ�ӳɷ�Ӧ�����Ҵ�����Ӧ�Ļ�ѧ����ʽΪCH2 = CH2 + H2O![]() CH3CH2OH���ʴ�Ϊ���ӳɷ�Ӧ��
CH3CH2OH���ʴ�Ϊ���ӳɷ�Ӧ��
(3) a.�������θ���ܿ��Է��������ʴ�Ϊ����������
b.�Թܢ��м��б���Na2CO3��Һ�������ܽ��Ҵ����к����ᣬ�������������ܽ�ȣ��ʴ�Ϊ���ܽ��Ҵ����к����ᣬ�������������ܽ�ȣ�
c. 184g�Ҵ������ʵ�����184g��46g/mol=4mol��90g��������ʵ�����90g��60g/mol=1.5mol�������Ҵ��������Է�Ӧ��������������Ӧ�ð������������㣬������Ӧ�ò�������������������1.5mol��88g/mol=132g��ʵ�ʷ�Ӧ������106gE����÷�Ӧ�IJ���(106g��132g)��100%=80.3%���ʴ�Ϊ��80.3%��
(4) D��E�Ļ�ѧ����ʽ��2CH3CH2OH+O2![]() 2CH3CHO+2H2O���ʴ�Ϊ��2CH3CH2OH+O2
2CH3CHO+2H2O���ʴ�Ϊ��2CH3CH2OH+O2![]() 2CH3CHO+2H2O��
2CH3CHO+2H2O��
(5) H�����Ӿ۷�Ӧ�ķ���ʽ��n CH2=CH2![]()
![]() ���ʴ�Ϊ��n CH2=CH2
���ʴ�Ϊ��n CH2=CH2![]()
![]() ��
��
(6) GΪCH3COOCH2CH3������CH3CH2COOH��Ϊͬ���칹�� ����G������ͬ�����ţ�˵���������࣬����������ͬ���칹���У�HCOOC2H5 CH3COOCH3���ʴ�Ϊ��HCOOC2H5 CH3COOCH3��


 �����ܾ�ϵ�д�
�����ܾ�ϵ�д� ���ƿ�����ϵ�д�
���ƿ�����ϵ�д� ���¿쳵����������ϵ�д�
���¿쳵����������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ƻ��֭�к���Fe2������ե��ƻ��֭�ڿ����л���dz��ɫ��Ϊ�ػ�ɫ����ե֭ʱ����ά����C������Ч��ֹ��������������˵��ά����C����
A�������� B����ԭ�� C������ D������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʱ���ڡ����ݸ�Ŀ����д��:���վƷǹŷ�Ҳ����Ԫʱʼ���䷨����Ũ�ƺ�����굣���������,������ȡ��¶���������漰�IJ���������
A. ���� B. ���� C. ��ȡ D. ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��p(Ba2+)=-lgc(Ba2+), p(�������)=-lgc(�������),�������ΪSO42-��CO32-��ij�¶���BaSO4��BaCO3�ij����ܽ��ϵ��ͼ��ʾ������������ȷ����
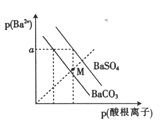
A. p(Ba2+)=aʱ����Һ��c(SO42-)��c(CO32-)
B. M���Ӧ����Һ����BaCO3 ��������
C. ��ͼ��֪���¶��£�Ksp(BaSO4)3)
D. BaSO4 ��������ת��ΪBaCO3 ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��Ӧԭ���ڿ��к��������й㷺Ӧ�á�
��1����֪��3Fe2O3(s)+CO(g)=2Fe3O4(s)+4CO2(g) ��H1=-47kJ/mol��
Fe3O4(s)+4CO(g)=3Fe(s)+4CO2(g) ��H2=-14kJ/mol��
��Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ��H=________��
��2��ú������ҵ�г���ͨ���о���ͬ�¶��·�Ӧ��ƽ�ⳣ�����������ʵ�����⡣���������CO��H2O(g)ͨ��һ�����ܱ������У�������Ӧ��CO(g)+H2O(g)![]() H2(g)+CO2(g)���÷�Ӧ��ƽ�ⳣ�����¶ȵı仯���±���ʾ��
H2(g)+CO2(g)���÷�Ӧ��ƽ�ⳣ�����¶ȵı仯���±���ʾ��
�¶ȣ��� | 400 | 500 | 800 |
ƽ�ⳣ��K | 9.94 | 9 | 1 |
�� �÷�Ӧ��ƽ�ⳣ������ʽK=_______���÷�Ӧ������Ӧ��_______��������������������������Ӧ��
�� ����Ӧ��800��ʱ����, CO��H2O(g)����ʼŨ�Ⱦ�Ϊ0.020 mol��L-1����������£�CO��ƽ��ת����Ϊ_________��
�� ���д�ʩ���ܹ����COת���ʵ���______������ĸ��
a�������¶� b��������� c������CO��Ũ�� d.����H2O(g)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ������������أ������й�˵���������
A. ����������������ҩ
B. �轺��������װʳƷ�ĸ����
C. Ũ����ɿ�ʴʯӢ�Ƶ�����Ʒ
D. �����к��ж���ά����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ŷ�����պ���̼��˰��Ӧ�Ա����ڻ���ȫ���ů��ʹ�ö���ν��ʹ�����CO2�ĺ�������Ч�ؿ�������̼��Դ���о��Եø��ӽ��ȡ������û�ѧ��Ӧԭ�������֪ʶ�о�̼���仯��������ʡ�
��1�����������ҹ�����̼�����о�ȡ���ش��չ���õ绡���ϳɵ�̼�����г����д���̼�����������ʣ�������̼���������������������ᴿ������ɲ���ƽ������ѧ����ʽ��
��C����K2Cr2O7+��______=��CO2��+��K2SO4+��Cr2(SO4)3+��H2O
��2���״���һ������ȼ�ϣ��״�ȼ�ϵ�ؼ�����ʵ��������ҵ����������ҵ��һ����CO��H2Ϊԭ�Ϻϳɼ״����÷�Ӧ���Ȼ�ѧ����ʽΪ��CO(g)+2H2(g)=CH3OH(g) ��H1=-116kJ/mol
�����д�ʩ������������÷�Ӧ�ķ�Ӧ���ʵ���_______������ĸ���ţ���
A����ʱ��CH30H�뷴Ӧ�������� B.���ͷ�Ӧ�¶�
C.������ϵѹǿ D.ʹ�ø�Ч����
����֪��CO(g)+1/2O2(g)=CO2(g) ��H2=-283kJ/mol
H2(g)+1/2O2(g)=H2O(g) ��H3=-242kJ/mol
���ʾlmol��̬�״���ȫȼ������CO2��ˮ����ʱ���Ȼ�ѧ����ʽΪ______________��
�����ݻ�Ϊ1L�ĺ��������У��ֱ��о���230�桢250���270�� �����¶��ºϳɼ״��Ĺ��ɡ���ͼ�����������¶��²�ͬ��H2��CO����ʼ��ɱȣ���ʼʱCO�����ʵ�����Ϊlmol����COƽ��ת���ʵĹ�ϵ��

��ش�
i�������������¶��У�����Z��Ӧ���¶���_________��
ii������ͼ��a���Ӧ�����ݣ����������Z�ڶ�Ӧ�¶��£���ӦCO(g)+2H2(g)=CH3OH(g)��ƽ�ⳣ��K=__________��
��3��CO2����Ȼ��ѭ��ʱ����CaCO3��Ӧ��CaCO3��һ���������ʣ���Ksp=2.8��10-9�� CaCl2��Һ��Na2CO3��Һ��Ͽ��γ�CaCO3�������ֽ��������CaCl2��Һ��Na2CO3��Һ��ϣ���Na2CO3��Һ��Ũ��Ϊ5.6��10-5mol/L�������ɳ�������CaCl2��Һ����СŨ��Ϊ______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�˼������ˮ����ijѧ�����������ʵ�鷽����

�ش��������⣺
��1���Լ�1��_____________��
��2���Լ�2��_____________��������_______________________��
��3����μ���ڢٲ�ʵ���ѻ������_________________________________________��
��4��д��������ƹ����漰����ѧ����ʽ��______________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����20g�������ƹ������1 mol��L��1��NaOH��Һ��������Һ�������
A��1000 mL B�� 500 mL C��100 mL D��50 mL
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com