
| A、y=2(x+0.1) | ||
B、x=
| ||
| C、y=2x-0.1 | ||
D、x=0.1+
|
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、两个碳原子以单键相连 |
| B、乙基与一个氢原子相连就是乙烷分子 |
| C、分子里都含6个相同的氢原子 |
| D、乙基与一个羟基相连就是乙醇分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 镁_次氯酸盐燃料电池具有比能量高、安全方便等优点,该电池主 要工作原理如右图所示,其正极反应为:ClO-+H2O+2e-═Cl-+2OH-,关于该电池的叙述正确的是( )
镁_次氯酸盐燃料电池具有比能量高、安全方便等优点,该电池主 要工作原理如右图所示,其正极反应为:ClO-+H2O+2e-═Cl-+2OH-,关于该电池的叙述正确的是( )| A、该电池中镁为负极,发生还原反应 |
| B、电池工作时,OH-向正极移动 |
| C、电池工作时,正极周围溶液的pH将不断变小 |
| D、该电池的总反应式为:Mg+ClO-+H2O═Mg(OH)2↓+Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1种 | B、5种 | C、9种 | D、12种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
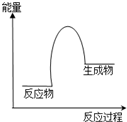 根据如图提供的信息,不能够得到的结论是( )
根据如图提供的信息,不能够得到的结论是( )| A、该反应一定有能量转化成了生成物的化学能 |
| B、该反应中化学能转化成了热能,为放热反应 |
| C、该反应生成物的总能量高于反应物的总能量 |
| D、该反应过程中有比生成物能量更高的中间物质生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、①③ | C、②③ | D、①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 180℃ |
| 催化剂 |
| A、若其他条件不变,反应温度改为400℃,能更快达到同样的氮氧化物去除率 |
| B、若其他条件不变,改用高效催化剂,能更快达到同样的氮氧化物去除率 |
| C、平衡时,其他条件不变,再向容器中通入NH3,氮氧化物去除率将高于80% |
| D、平衡时,其他条件不变,再升高温度可使该反应的平衡常数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、SO3的水溶液能导电,所以SO3是电解质 |
| B、氯化钠晶体不导电,但是氯化钠是电解质 |
| C、氯化钠溶液能导电,所以氯化钠溶液是电解质 |
| D、液态氯化氢不能导电,但是氯化氢是电解质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com