
分析 ①氢氧化铝与盐酸反应生成氯化铝和水;
②碳酸钙与盐酸反应生成氯化钙、二氧化碳和水;澄清石灰水通入少量二氧化碳反应生成碳酸钙和水;
③氧化铁与稀硫酸反应生成硫酸铁和水;铁与稀硫酸反应生成硫酸亚铁和氢气.
解答 解:①氢氧化铝与盐酸反应生成氯化铝和水,离子方程式:Al(OH)3+3H+=Al3++3H2O;
故答案为:Al(OH)3+3H+=Al3++3H2O;
②碳酸钙与盐酸反应生成氯化钙、二氧化碳和水,离子方程式:CaCO3+2H+=Ca2++H2O+CO2↑; 澄清石灰水通入少量二氧化碳反应生成碳酸钙和水,离子方程式:Ca2++2OH-+CO2=CaCO3↓+H2O;
故答案为:CaCO3+2H+=Ca2++H2O+CO2↑; Ca2++2OH-+CO2=CaCO3↓+H2O;
③表面附有铁锈(成分是Fe2O3)的铁钉放入稀硫酸中,开始氧化铁与稀硫酸反应生成硫酸铁和水,离子方程式是:Fe2O3+6H+=2Fe3++3H2O
反应片刻后,可观察到有气体产生,铁与稀硫酸反应生成硫酸亚铁和氢气,离子方程式是:Fe+2H+=Fe2++H2↑;
故答案为:Fe2O3+6H+=2Fe3++3H2O;Fe+2H+=Fe2++H2↑.
点评 本题考查了离子方程式的书写,明确物质的性质及发生反应的实质是解题关键,题目难度不大.


科目:高中化学 来源: 题型:解答题
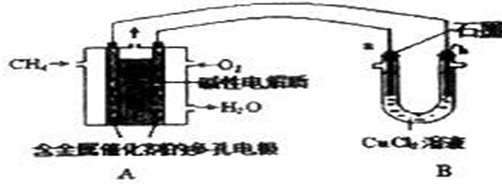
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 溶 液 | 加入的物质 | 答案序号 |
| (1)饱和石灰水 | CO2 | |
| (2)AlCl3溶液 | 过量NH3 | |
| (3)含少量NaOH的NaAlO2 | 过量CO2 | |
| (4)含少量NaOH的NaAlO2 | 逐滴加稀盐酸 | |
| (5)MgCl2、AlCl3混合液 | 逐滴加NaOH至过量 | |
| (6)NaOH溶液 | 逐滴加AlCl3至过量 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某实验小组用如图装置制备家用消毒液,并探究其性质.反应停止后,取洗气瓶中无色溶液5mL,分别进行了如下实验:
某实验小组用如图装置制备家用消毒液,并探究其性质.反应停止后,取洗气瓶中无色溶液5mL,分别进行了如下实验:| 操作 | 现象 |
| a.测溶液pH,并向其中滴加2滴酚酞 | pH=3,溶液变红,5min后褪色 |
| b.向其中逐滴加入盐酸 | 溶液逐渐变成黄绿色 |
| 操作 | 现象 |
| 取5mLpH=13NaOH溶液,向其中滴加2滴酚酞 | 溶液变红,30min后褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在0.2L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示,回答下列问题:
在0.2L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
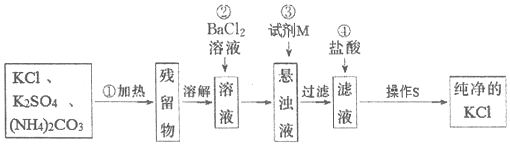
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
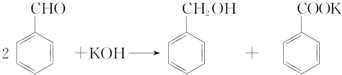
| 名称 | 性状 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 水溶性 |
| 苯甲醛 | 无色液体,苦杏仁味 | -26 | 178.1 | 1.041 5 | 微溶 |
| 苯甲酸 | 白色片状或针状晶体 | 122.4 | 248 | 1.265 9 | 微溶 |
| 苯甲醇 | 无色液体,有芳香味 | -15.3 | 205.35 | 1.041 9 | 微溶 |
| 乙醚 | 无色透明液体, 有特殊刺激性气味 | -116.3 | 34.6 | 0.71 | 不溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com