
(10分) Ⅰ研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s)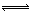 NaNO3(s)+ClNO(g) K1 ?H < 0 (I)
NaNO3(s)+ClNO(g) K1 ?H < 0 (I)
2NO(g)+Cl2(g)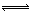 2ClNO(g) K2 ?H < 0 (II)
2ClNO(g) K2 ?H < 0 (II)
(1)4NO2(g)+2NaCl(s)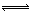 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K= (用K1、K2表示)。
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K= (用K1、K2表示)。
(2)为研究不同条件对反应(II)的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2,10min时反应(II)达到平衡。测得10min内v(ClNO)=7.5×10-3mol?L-1?min-1,则平衡后n(Cl2)= mol,NO的转化率а1= 。其它条件保持不变,反应(II)在恒压条件下进行,平衡时NO的转化率а2 а1(填“>”“<”或“=”),平衡常数K2 (填“增大”“减小”或“不变”。若要使K2减小,可采用的措施是 。
(3)已知t℃时,反应FeO(s)+CO(g) Fe(s)+CO2(g)的平衡常数K=0.25。
Fe(s)+CO2(g)的平衡常数K=0.25。
①t℃时,反应达到平衡时n(CO):n(CO2)= 。
②若在1 L密闭容器中加入0.02 mol FeO(s),并通入xmolCO,t℃时反应达到平衡。此时FeO(s)转化率为50%,则x= 。
(1)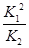 (2)0.025;75%;>;不变;升高温度 (4)4:1 0.05
(2)0.025;75%;>;不变;升高温度 (4)4:1 0.05
解析试题分析:(1)2NO2(g)+NaCl(s) NaNO3(s)+ClNO(g),△H1<0 (Ⅰ),平衡常数K1=
NaNO3(s)+ClNO(g),△H1<0 (Ⅰ),平衡常数K1=
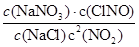 ,2NO(g)+Cl2(g)
,2NO(g)+Cl2(g) 2ClNO(g),△H2<0 (Ⅱ),平衡常数K2 =
2ClNO(g),△H2<0 (Ⅱ),平衡常数K2 =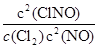 ,
,
(1)4NO2(g)+2NaCl(s) 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=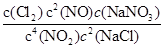 ,计算得到K=
,计算得到K=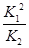 。
。
(2)在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2,10min时反应(Ⅱ)达到平衡,测得10min内v(ClNO)=7.5×10-3mol?L-1?min-1,物质的量为7.5×10-3mol?L-1?min-1×10min×2L=0.15mol,依据平衡三段式列式计算;
2NO(g)+Cl2(g) 2ClNO(g)
2ClNO(g)
起始量(mol) 0.2 0.1 0
变化量(mol) 0.15 0.075 0.15
平衡量(mol) 0.05 0.025 0.15
则平衡后n(Cl2)=0.025mol
NO的转化率α1=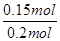 ×100%=75%
×100%=75%
其他条件保持不变,反应(Ⅱ)在恒压条件下进行,随反应进行,气体体积减小,为保持恒压所以容器体积减小,压强增大,平衡正向进行,平衡时NO的转化率α2增大;平衡常数随温度变化,不随浓度、压强变化,若要使K2减小,平衡逆向进行,反应是放热反应,依据平衡移动原理应升高温度,平衡逆向进行。
(3)①t℃时,反应达到平衡时根据平衡常数表达式K=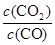 =0.25可知,平衡时n(CO):n(CO2)=1:0.25=4:1。
=0.25可知,平衡时n(CO):n(CO2)=1:0.25=4:1。
② FeO(s)+CO(g) Fe(s)+CO2(g)
Fe(s)+CO2(g)
起始浓度(mol/L) x 0
变化浓度(mol/L) 0.01 0.01
平衡浓度(mol/L) x-0.01 0.01
所以0.01÷(x-0.01)=0.25
解得x=0.05
考点:考查化学平衡常数的计算,影响化学平衡的因素分析应用等


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:单选题
将2 mol SO2和1 mol O2充入一容积固定的密闭容器中,在一定条件下发生反应:2SO2(g)+O2(g) 2SO3(g),下列哪些量不再变化时,并不能说明化学反应已达平衡状态( )
2SO3(g),下列哪些量不再变化时,并不能说明化学反应已达平衡状态( )
| A.混合气体的密度 | B.混合气体的压强 |
| C.混合气体的总物质的量 | D.混合气体的平均相对分子质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
对于反应2SO2(g)+O2(g) 2SO3(g)能增大正反应速率的措施是( )
2SO3(g)能增大正反应速率的措施是( )
| A.通入大量O2 | B.增大容器容积 |
| C.移去部分SO3 | D.降低体系温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
乙酸蒸气能形成二聚分子: 2CH3COOH(气) (CH3COOH)2(气)+热。现欲测定乙酸的分子量,应采用的反应条件是( )
(CH3COOH)2(气)+热。现欲测定乙酸的分子量,应采用的反应条件是( )
| A.低温高压 | B.高温低压 | C.低温低压 | D.高温高压 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
被称为人体冷冻学之父的罗伯特·埃廷格(Robert Ettinger)在1962年写出《不朽的前景》(The Prospect Of Immortality)一书。他在书中列举了大量事实,证明了冷冻复活的可能。比如,许多昆虫和低等生物冬天都冻僵起来,春天又自动复活。下列结论中与上述信息相关的是
| A.温度越低,化学反应越慢 | B.低温下分子无法运动 |
| C.温度降低,化学反应停止 | D.化学反应前后质量守恒 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(16分)I.将一定量NO2和N2O4的混合气体通入体积为1L的恒温密闭容器中,各物质浓度随时间变化的关系如图1所示。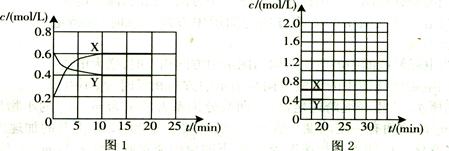
请回答:
(1)下列选项中不能说明该反应已达到平衡状态的是 (填选项字母)。
| A.容器内混合气体的压强不随时间变化而改变 |
| B.容器内混合气体的密度不随时间变化而改变 |
| C.容器内混合气体的颜色不随时间变化而改变 |
| D.容器内混合气体的平均相对分子质量不随时间变化而改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在容积为1L的密闭容器中,进行如下反应:A(g)+2B(g) C(g)+D(g),最初加入1.0molA和2.2molB,在不同温度下,D的物质的量n(D)和时间t的关系如图。试回答下列问题:
C(g)+D(g),最初加入1.0molA和2.2molB,在不同温度下,D的物质的量n(D)和时间t的关系如图。试回答下列问题:
(1)800℃时,0—5min内,以B表示的平均反应速率为
(2)能判断该反应达到化学平衡状态的依据是
A.容器中压强不变 B.混合气体中c(A)不变
C.2v正(B)=v逆(D) D.c(A)=c(C)
(3)若最初加入1.0molA和2.2molB,利用图中数据计算800℃时的平衡常数K= ,
该反应为 反应(填吸热或放热)
(4)700℃时,某时刻测得体系中各物质的量如下:n(A)=1.1mol,n(B)=2.6mol,n(C)=0.9mol,n(D)=0.9mol,则此时该反应 进行(填“向正反应方向”“向逆反应方向”或“处于平衡状态”)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(8分) CO2是最重要温室气体,如何降低大气中CO2的含量及有效地开发利用CO2具有重大意义。
(1)科学家用H2和CO2生产甲醇燃料。为探究该反应原理,进行如下实验:某温度下,在容积为2 L的密闭容器中充入1 mol CO2和3.25 mol H2,在一定条件下反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间的变化关系如图所示。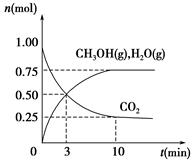
①写出该反应的化学方程式_______________________ 计算从反应开始到3 min时,氢气的平均反应速率v(H2)=____________________。
②下列措施中一定能使CO2的转化率增大的是___________________ 。
A 在原容器中再充入1 mol H2 B 在原容器中再充入1 mol CO2
C 缩小容器的容积 D 使用更有效的催化剂
E.在原容器中充入1 mol He F.将水蒸气从体系中分离出
(2)科学家还利用氢气在一定条件下与二氧化碳反应生成乙醇燃料,其热化学反应方程式为:2CO2(g)+6H2(g)  CH3CH2OH(g)+3H2O(g) ΔH=a kJ·mol-1,
CH3CH2OH(g)+3H2O(g) ΔH=a kJ·mol-1,
(3)在一定压强下,测得该反应的实验数据如表所示。请根据表中数据回答下列问题。
 温度(K) 温度(K) CO2转化率/(%) CO2转化率/(%)n(H2)/n(CO2) | 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2 | 60 | 43 | 28 | 15 |
| 3 | 83 | 62 | 37 | 22 |
 的值,CO2转化率_________,生成乙醇的物质的量________(填“增大”、“减小”、“不变”或“不能确定”)。
的值,CO2转化率_________,生成乙醇的物质的量________(填“增大”、“减小”、“不变”或“不能确定”)。查看答案和解析>>
科目:高中化学 来源: 题型:填空题
据图回答下列问题: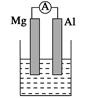
Ⅰ、(1)若烧杯中溶液为稀硫酸,则观察到的现象是______________________
负极反应式为:_________________________________________________。
(2)若烧杯中溶液为氢氧化钠溶液,则负极为________(填Mg或Al),总反应化学方程式为
______________________________________________________________。
Ⅱ、由Al、Cu、浓硝酸组成原电池,其正极的电极反应式为
Ⅲ、(1)甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇: CO(g)+2H2(g)  CH3OH(g)。
CH3OH(g)。
分析该反应并回答下列问题:下列各项中,不能够说明该反应已达到平衡的是________(填序号)。
a.恒温、恒容条件下,混合气体的平均相对分子质量不变
b.一定条件下,CH3OH分解的速率和CH3OH生成的速率相等
c.一定条件下,CO、H2和CH3OH的浓度保持不变
d.一定条件下,单位时间内消耗2 mol H2,同时生成1 mol CH3OH
(2)2009年10月,中国科学院长春应用化学研究所在甲醇燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆。甲醇燃料电池的工作原理如下图所示。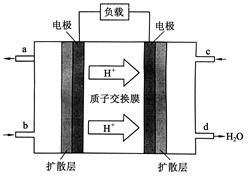
①该电池工作时,b口通入的物质为________________,
c口通入的物质为________________。
②该电池负极的电极反应式为:_______
③工作一段时间后,当6.4 g甲醇完全反应生成CO2时,
有______________NA个电子转移。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com