��Դ��ȱ���������ٵ��ش����⣮�״���һ�ֿ�������Դ�����й㷺�Ŀ�����Ӧ��ǰ������˼״�����Ϊ21���͵����Ͳ��ϣ���ҵ����CO�����״���һ�������·�����Ӧ��CO��g��+2H
2��g��?CH
3OH��g����ͼ1��ʾ��Ӧ�������ı仯��ͼ2��ʾһ���¶��£������Ϊ2L���ܱ������м���4molH
2��һ������CO��CO��CH
3OH��g����Ũ����ʱ��仯ͼ����ش��������⣺
��1���ڡ�ͼ1���У�����
���a����b������ʾʹ���˴������÷�Ӧ����
������ȡ����ȡ�����Ӧ��
��2�����ݡ�ͼ2���жϣ�����˵������ȷ����
A����ʼ�����COΪ1mol
B������COŨ�ȣ�CO��ת��������
C��������ѹǿ�㶨ʱ����Ӧ�Ѵﵽƽ��״̬
D�������¶Ⱥ��ܱ������ݻ����䣬�ٳ���1mol CO��2mol H
2�����ٴδﵽƽ��ʱ
������
��3���ӷ�Ӧ��ʼ������ƽ�⣬v��H
2��=
�����¶���CO��g��+2H
2��g��?CH
3OH��g���Ļ�ѧƽ�ⳣ��Ϊ
�������������������䣬����Ӧ��ϵ���£���÷�Ӧ�Ļ�ѧƽ�ⳣ����
�����������С�����䡱����
��4�����ڡ�ͼ3���л���ƽ��ʱ�״������ٷֺ����������꣩���¶ȣ������꣩�仯�����ߣ�Ҫ��ѹǿ��ͬ��2�����ߣ��������ϱ��P
1��P
2����P
1��P
2������
��5����ѧ�ҳ���
�����������ƣ���ֱ�Ӳⶨijһ��Ӧ�ķ�Ӧ�ȣ��ֲ�ã�CH
3OH��g��+
O
2=CO
2��g��+2H
2O��g����H=-192.9KJ/mol����֪H
2O��l��=H
2O��g����=44KJ/mol�����32g��CH
3OH��g����ȫȼ������Һ̬ˮ���Ȼ�ѧ����ʽ
��


 ij���Ӿ��徧���ṹ��ͼ������Xλ��������Ķ��㣬����Yλ������������ģ��Է�����
ij���Ӿ��徧���ṹ��ͼ������Xλ��������Ķ��㣬����Yλ������������ģ��Է�����




 �������������ʡ�����ȵ���Ҫԭ�ϣ�Χ�ƺϳɰ����ǽ�����һϵ�е��о�
�������������ʡ�����ȵ���Ҫԭ�ϣ�Χ�ƺϳɰ����ǽ�����һϵ�е��о�
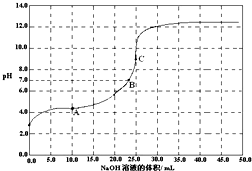 ����ʱ����0.1000mol/L NaOH �ζ� 25.00mL 0.1000mol/LijһԪ��HX���ζ�������pH �仯������ͼ��ʾ������˵����ȷ���ǣ�������
����ʱ����0.1000mol/L NaOH �ζ� 25.00mL 0.1000mol/LijһԪ��HX���ζ�������pH �仯������ͼ��ʾ������˵����ȷ���ǣ�������