
| A. | 2-甲基丙烷 正丁烷 | B. | 氧气 臭氧 | ||
| C. |  | D. | 金刚石 石墨 |
科目:高中化学 来源: 题型:选择题
| A. | 含3.01×1023个SO42- | B. | 标准状况下,体积约为11.2L | ||
| C. | 含0.5molNa+ | D. | 含1mol氧原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下11.2L CO2和0.5 molCO2 | |
| B. | 18 mL H2O和2x10Pa,27C 16gO2 | |
| C. | 1 molCO和88gCO2 | |
| D. | 27℃,22.4 LCl2和含4mol氧原子的H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铜是过渡金属元素,可以形成多种化合物.
铜是过渡金属元素,可以形成多种化合物.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
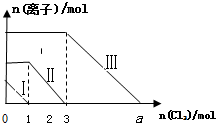 向仅含Fe2+、I-、Br-的溶液通入适量氯气,溶液中这三种离子的物质的量的变化如图所示. (已知氧化性:Br2>Fe3+>I2)请回答下列问题:
向仅含Fe2+、I-、Br-的溶液通入适量氯气,溶液中这三种离子的物质的量的变化如图所示. (已知氧化性:Br2>Fe3+>I2)请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 将氢氧化钠固体放在滤纸上称量 | |
| B. | 用10ml量筒量取8.58ml蒸馏水 | |
| C. | 容量瓶定容时观察液面时俯视,会使配得的溶液浓度偏大 | |
| D. | 用托盘天平可以称量至0.1g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 离子组 | 加入试剂 | 发生反应的离子方程式 |
| A | Fe3+、S2ˉ、Clˉ、Na+ | NaOH溶液 | Fe3++3OHˉ═Fe(OH)3↓ |
| B | H+、Fe2+、SO42ˉ、NO3ˉ | BaCl2溶液 | SO42ˉ+Ba2+═BaSO4↓ |
| C | Na+、Al3+、Clˉ、SO42ˉ | 少量KOH溶液 | Al3++3OHˉ═Al(OH)3↓ |
| D | Na+、K+、ClOˉ、SO42ˉ | 通入少量SO2 | 2ClOˉ+SO2+H2O═2HClO+SO32ˉ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com