
【题目】蒽(![]() )与苯炔(
)与苯炔(![]() )反应生成化合物X(立体对称图形),如下图所示:
)反应生成化合物X(立体对称图形),如下图所示:
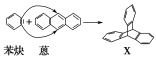
(1)蒽与X都属于________。
a.环烃 b.烃 c.不饱和烃
(2)苯炔的分子式为________,苯炔不具有的性质是________。
a.能溶于水 b.能发生氧化反应
c.能发生加成反应 d.常温常压下为气体
(3)下列属于苯的同系物的是________(填字母)。
A. 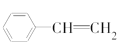
B. 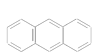
C. 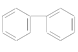
D. ![]()
(4)下列物质中,能发生加成反应,也能发生取代反应,同时能使溴水因加成反应而退色,还能使酸性高锰酸钾溶液退色的是___。
A. ![]()
B.C6H14
C. ![]()
D. ![]()
科目:高中化学 来源: 题型:
【题目】(1)对于下列反应:2SO2 +O2![]() 2SO3,如果2min内SO2的浓度由6 mol/L下降为2 mol/L,那么用O2浓度变化来表示的反应速率为________。如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L·min),那么2min时SO2的浓度为_______。
2SO3,如果2min内SO2的浓度由6 mol/L下降为2 mol/L,那么用O2浓度变化来表示的反应速率为________。如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L·min),那么2min时SO2的浓度为_______。
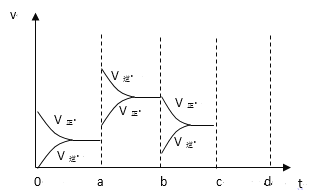
(2)下图左表示在密闭容器中反应:2SO2+O2![]() 2SO3+Q达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a-b过程中改变的条件可能是_____;b-c过程中改变的条件可能是________;若增大压强时,反应速度变化情况画在c~d处。_______
2SO3+Q达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a-b过程中改变的条件可能是_____;b-c过程中改变的条件可能是________;若增大压强时,反应速度变化情况画在c~d处。_______
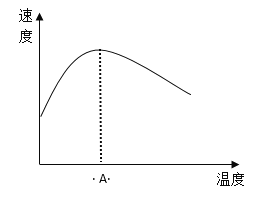
(3)酶是蛋白质,具有蛋白质的特性,酶能催化很多化学反应,下图表示酶参加的反应中,温度与反应速率的关系。解释曲线变化原因 __________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国化学家研究的一种新型复合光催化剂![]() 碳纳米(CQDs)/氮化碳(C3N4)纳米复合物
碳纳米(CQDs)/氮化碳(C3N4)纳米复合物![]() 可以利用太阳光实现高效分解水,其原理如图所示。下列说法正确的是
可以利用太阳光实现高效分解水,其原理如图所示。下列说法正确的是
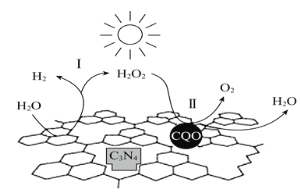
A.C3N4中C的化合价为-4
B.反应的两个阶段均为非氧化还原
C.阶段Ⅱ中,H2O2既是氧化剂,又是还原剂
D.通过该反应,实现了化学能向太阳能的转化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酰氯(SO2Cl2)熔点-54.1℃、沸点69.2℃,在染料、药品、除草剂和农用杀虫剂的生产过程中有重要作用。
(1)SO2Cl2中S的化合价为___________,SO2Cl2在潮湿空气中因水解“发烟”的化学方程式为__________。
(2)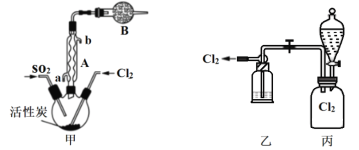
①仪器A的名称为___________,装置B的作用是____________。
②装置乙中装入的试剂是浓硫酸,装置丙分液漏斗中盛装的最佳试剂是________(选填字母)。
A.蒸馏水 B.10.0 molL1浓盐酸 C.浓氢氧化钠溶液 D.饱和食盐水
③滴定法测定硫酰氯的纯度:取1.800g产品,加入到100mL 0.5000mol·L1 NaOH溶液中加热充分水解,冷却后加蒸馏水准确稀释至250mL,取25mL溶液于锥形瓶中,滴加2滴甲基橙,用0.1000mol·L1标准HCl滴定至终点,重复实验三次取平均值,消耗10.00mL滴定终点的判断为___________,产品的纯度为_________。
(3)探究硫酰氯在催化剂作用下加热分解的产物,实验装置如图所示(部分夹持装置未画出)。

①加热时A中试管出现黄绿色,装置B的作用是_________。
②装置C中反应的离子方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2 L密闭容器中,A、B、C三种气体的物质的量随时间变化的曲线如图所示。下列说法正确的是
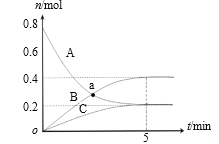
A.a点时,υ(A) =υ(B)
B.反应开始到5min,B的物质的量增加了0.2 mol
C.反应的化学方程式为:3A![]() 2B+C
2B+C
D.反应开始到5min,υ(C) =0.04 mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用苯和浓硝酸、浓硫酸发生反应制取硝基苯的装置如图所示。回答下列问题:
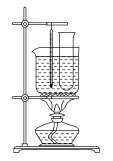
(1)反应需在50~60 ℃的温度下进行,图中给反应物加热方法是____。它的优点是___和_____
(2)在配制混合酸时应将________加入________中。
(3)该反应的化学方程式是_____________。
(4)由于装置的缺陷,该实验可能导致的不良后果是________
(5)反应完毕后,除去混合酸,所得粗产品用如下操作精制:①蒸馏 ②水洗 ③用干燥剂干燥 ④10% NaOH溶液洗 ⑤水洗,其中正确的操作顺序是________。
A.①②③④⑤ B.②④⑤③①
C.④②③①⑤ D.②④①⑤③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下列实验探究亚硝酸钠(NaNO2)的化学性质(AgNO2是淡黄色难溶于水的固体)
实验 | 装置 | 试剂a | 现象 |
① |
| 酚酞 | 无色溶液变红 |
② | AgNO3溶液 | 产生淡黄色沉淀 | |
③ | 淀粉KI 溶液+稀硫酸 | 无色溶液立即变蓝 | |
④ | 酸性K2Cr2O7溶液 | 无色溶液变为绿色 |
由上述实验所得结论不正确的是
A.NaNO2溶液呈碱性:NO2-+H2OHNO2+OH-
B.NaNO2可与某些盐发生复分解反应:NO2-+Ag+=AgNO2↓
C.NaNO2有氧化性:2I-+2H++2NO2-=I2+2NO2↑+H2O
D.NaNO2有还原性:Cr2O72-+3NO2-+8H+=3NO3-+2Cr3++4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“乙醇催化氧化”的实验装置如图所示:
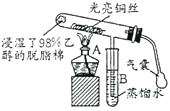
实验操作为:预先使棉花团浸透乙醇,并照图安装好仪器,在铜丝的中间部位加热片刻后,用气囊有节奏地鼓入空气,即可观察到以下明显的实验现象。
请回答以下问题:
(1)在实验过程中铜丝出现红色和黑色交替的现象,说明在该实验过程中催化剂_________![]() 填“参与了”或“没有参与”
填“参与了”或“没有参与”![]() 化学反应;写出乙醇催化氧化反应的化学方程式_________。
化学反应;写出乙醇催化氧化反应的化学方程式_________。
(2)在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明乙醇催化氧化反应是____反应。
(3)B中用蒸馏水收集到的物质可能有__________![]() 填物质的名称
填物质的名称![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知铅蓄电池充放电的总反应为:![]() ,下列关于铅蓄电池的说法正确的是( )
,下列关于铅蓄电池的说法正确的是( )
A. 在放电时,两极质量均增加
B. 在充电时,电池中硫酸的浓度不断变小
C. 在放电时,负极发生的反应是 Pb + 2e- + SO42-=PbSO4
D. 在放电时,正极发生的反应是 PbSO4 + 2e- =Pb + SO42-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com