
 碱性硼化钒(VB2)-空气电池工作时反应为:4VB2+11O2=4B2O3+2V2O5.用该电池为电源,选用惰性电极电解硫酸铜溶液,实验装置如图所示.当外电路中通过0.04mol电子时,B装置内共收集到0.448L气体(标准状况),则下列说法正确的是( )
碱性硼化钒(VB2)-空气电池工作时反应为:4VB2+11O2=4B2O3+2V2O5.用该电池为电源,选用惰性电极电解硫酸铜溶液,实验装置如图所示.当外电路中通过0.04mol电子时,B装置内共收集到0.448L气体(标准状况),则下列说法正确的是( )| A、VB2电极发生的电极反应为:2VB2+11H2O-22e-=V2O5+2B2O3+22H+ |
| B、外电路中电子由c电极流向VB2电极 |
| C、电解过程中,b电极表面先有红色物质析出,然后有气泡产生 |
| D、若B装置内的液体体积为200 mL,则CuSO4溶液的物质的量浓度为0.05mol/L |
| 0.448L |
| 22.4L/mol |
| 0.04-0.01×2 |
| 2 |
| 0.01 |
| 0.2 |


 作业辅导系列答案
作业辅导系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
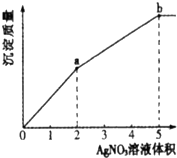 往含Cl-和I-的稀溶液中滴入AgNO3溶液,沉淀的质量与加入AgNO3溶液体积的关系如图所示.下列说法正确的是( )
往含Cl-和I-的稀溶液中滴入AgNO3溶液,沉淀的质量与加入AgNO3溶液体积的关系如图所示.下列说法正确的是( )| A、KSP(AgCl)<KSP(AgI) |
| B、c( Cl-):c( I-)=3:2 |
| C、m( AgCl ):m( AgI )=2:3 |
| D、a~b段产生黄色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Br- |
| B、SO42- |
| C、HSO3- |
| D、NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验前 | 实验后 | |
| 甲的质量/g | 101.1 | 103.8 |
| 乙的质量/g | 82.0 | 88.6 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙烯和甲烷都能发生加成反应 |
| B、CuSO4溶液能使鸡蛋清盐析而沉淀 |
| C、米酒变酸是因为乙醇被氧化为乙酸 |
| D、HNO3不能与苯发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 乙 |
| 乙 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com