
| A.Cu极附近OH-浓度增大 |
| B.Cu极为原电池负极 |
| C.电子流向是由C极流向Pt极 |
| D.当C极上有4mol电子转移时,Pt极上有1molO2生成 |
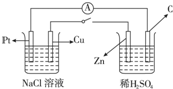
科目:高中化学 来源:不详 题型:单选题
| A.Fe、Cu、浓硝酸溶液,负极反应式为:Fe-2e-═Fe2+ |
| B.Al、Cu、稀硫酸,负极反应式为:Cu-2e-═Cu2+ |
| C.Al、Mg、NaOH溶液,负极反应式为:Al+4OH--3e-═[Al(OH)4]- |
| D.Zn、Cu、乙醇,负极反应式为:Zn-2e-═Zn2+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.水果电池是方便实用的家用电池 |
| B.铅蓄电池是一种常用的二次电池 |
| C.氢氧燃料电池是一种高效、无污染的发电装置 |
| D.锌锰干电池工作一段时间后,锌外壳逐渐变薄 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
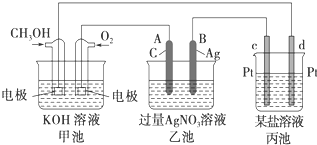
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
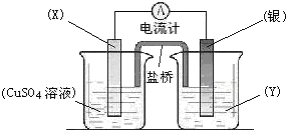
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.Ⅰ和Ⅱ中正极均被保护 |
| B.Ⅰ和Ⅱ中负极反应均是Fe-2e-=Fe2+ |
| C.Ⅰ和Ⅱ中正极反应均是O2+2H2O+4e-=4OH- |
| D.Ⅰ和Ⅱ中分别加入少量K3[Fe(CN)6]溶液,均有蓝色沉淀 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:多选题
| A.2FeCl3+Fe═3FeCl2 |
| B.H2SO4+2NaOH═Na2SO4+2H2O |
| C.Cl2+2NaOH═NaCl+NaClO+H2O |
| D.2H2+O2═2H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.K处连接时,电流从锌棒经导线流入铜棒 |
| B.K处不连接时,化学能转化为热能 |
| C.K处连不连接,纯锌溶解的速率不变 |
| D.把稀H2S04溶液可换成乙醇或乙酸溶液,实验效果都一样 |
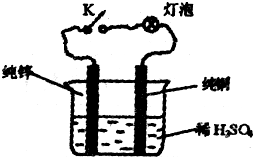
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com