
 (1)如图所示为冰晶石(化学式为Na3AlF6)的晶胞.图中●位于大立方体顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,▽是图中●、○中的一种.图中●、○分别指代哪种粒子
(1)如图所示为冰晶石(化学式为Na3AlF6)的晶胞.图中●位于大立方体顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,▽是图中●、○中的一种.图中●、○分别指代哪种粒子| 熔点/K | 沸点/K | 标准状况时在水中的溶解度 | |
| H2S | 187 | 202 | 2.6 |
| H2O2 | 272 | 423 | 以任意比互溶 |
| 1 |
| 8 |
| 1 |
| 2 |
| 1 |
| 4 |


科目:高中化学 来源: 题型:
 Ⅰ.甲、乙两种元素是同一短周期的相邻元素,乙元素的原子是同周期元素中未成对p电子数最多的,甲元素有多种同素异形体,其中一种能导电.
Ⅰ.甲、乙两种元素是同一短周期的相邻元素,乙元素的原子是同周期元素中未成对p电子数最多的,甲元素有多种同素异形体,其中一种能导电.查看答案和解析>>
科目:高中化学 来源: 题型:
碳是形成化合物最多的元素,其单质与化合物广布于自然界。![]()
![]()
![]()
![]()
![]()

![]()
![]()
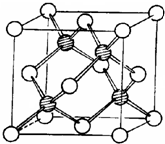
(1)碳原子的核外电子排布式为 。与碳同周期的非金属元素N的第一电离能大于O的第一电离能,原因是 ;
 (2)CS2是一种重要的有机溶剂,CS2分子的空间构型为 ;写出一种与CS2互为等电子体的物质的化学式 ;
(2)CS2是一种重要的有机溶剂,CS2分子的空间构型为 ;写出一种与CS2互为等电子体的物质的化学式 ;
(3)冰晶胞中水分子的空间排列方式与金刚石晶胞(其晶胞结构如右图,其中空心球所示原子位于立方体的顶点或面心,实心球所示原子位于立方体内)类似。每个冰晶胞平均占有 个水分子,冰晶胞与金刚石晶胞微粒排列方式相同的原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
(15分)
⑴如图是Na、Cu、Si、H、C、N等元素单质的熔点高低的顺序,其中c、d均是热和电的良导体。
①请写出图中b单质对应元素原子的电子排布式 。
②单质a、f对应的元素以原子个数比1∶1形成的分子(相同条件下对H2的相对密度为13)中含 个σ键和 个π键。
③a与b的元素形成的10电子中性分子X的空间构型为 ;将X溶于水后的溶液滴入到AgNO3溶液中至过量,得到络离子的化学式为 ,其中X与Ag+之间以 键结合。
④上图是上述六种元素中的一种元素形成的含氧酸的结构,请简要说明该物质易溶于水的原因: 。
⑵碳是形成化合物最多的元素,其单质与化合物广布于自然界。
①与碳同周期的非金属元素N的第一电离能大于O的第一电离能,原因是 ;
②CS2是一种重要的有机溶剂,写出一种与CS2互为等电子体的物质的化学式 ;
③冰晶胞中水分子的空间排列方式与金刚石晶胞(其晶胞结构如上图,其中空心球所示原子位于立方体的顶点或面心,实心球所示原子位于立方体内)类似。每个冰晶胞平均占有 个水分子,冰晶胞与金刚石晶胞微粒排列方式相同的原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ. (1)水分子的立体结构是 ,水分子能与很多金属离子形成配合物,其原因是在氧原子上有 。
(2)冰晶胞中水分子的空间排列方式与金刚石晶胞(其晶胞结构如右图,其中空心所示原子位于立方体的顶点或面心,实心球所示原子位于立方体内)类似。每个冰晶胞平均占有 个水分子。冰晶胞与金刚石晶胞微粒排列方式相同的原因是 。
(3)实验测得冰中氢键的作用能为18.5kJ·mol—1,而冰熔化热为5.0kJ·mol-1,这说明 。
Ⅱ. (1)碘在不同溶剂中呈现紫色、棕色……一般认为溶液呈紫色的表明溶解了的“碘分子”并未和溶剂发生很强的结合。已知不同温度下,碘在石蜡油中的溶液呈紫色或棕色。请回答:温度低时溶液呈 色,温度高时溶液呈 色,因为 。
(2)在水晶的柱面上涂一层石蜡,用红热的针接触面中央,石蜡熔化后呈椭圆形;用玻璃代替水晶重复上述操作,熔化的石蜡则呈圆形。试用你所学过关于晶体性质的知识解释上述现象。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年辽宁省高三第四次模拟考试(理综)化学部分 题型:填空题
Ⅰ. (1)水分子的立体结构是 ,水分子能与很多金属离子形成配合物,其原因是在氧原子上有 。
(2)冰晶胞中水分子的空间排列方式与金刚石晶胞(其晶胞结构如右图,其中空心所示原子位于立方体的顶点或面心,实心球所示原子位于立方体内)类似。每个冰晶胞平均占有 个水分子。冰晶胞与金刚石晶胞微粒排列方式相同的原因是 。

(3)实验测得冰中氢键的作用能为18.5kJ·mol—1,而冰熔化热为5.0kJ·mol-1,这说明 。
Ⅱ. (1)碘在不同溶剂中呈现紫色、棕色……一般认为溶液呈紫色的表明溶解了的“碘分子”并未和溶剂发生很强的结合。已知不同温度下,碘在石蜡油中的溶液呈紫色或棕色。请回答:温度低时溶液呈 色,温度高时溶液呈 色,因为 。
(2)在水晶的柱面上涂一层石蜡,用红热的针接触面中央,石蜡熔化后呈椭圆形;用玻璃代替水晶重复上述操作,熔化的石蜡则呈圆形。试用你所学过关于晶体性质的知识解释上述现象。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com