
| A. | 在0.1molNaHSO4晶体中阳离子与阴离子总数为0.3NA | |
| B. | 1.0L0.1mol•L-1NH4NO3溶液中含有的铵根离子数是0.1×6.02×1023 | |
| C. | 7.8gNa2O2与足量CO2反应,转移的电子数为0.1NA | |
| D. | 向仅含0.2molFeI2的溶液中持续通入氯气,当有0.1molFe2+被氧化时,需通入标况下C121.12L |
分析 A、NaHSO4由1个钠离子和1个硫氢根离子构成;
B、铵根离子是弱碱阳离子,在溶液中会水解;
C、求出过氧化钠的物质的量,然后根据1mo过氧化钠与二氧化碳反应转移1mol电子来分析;
D、I-的还原性强于Fe2+,故向FeI2的溶液中持续通入氯气,氯气先与I-反应.
解答 解:A、NaHSO4由1个钠离子和1个硫氢根离子构成,故0.1mol硫酸氢钠中含0.1mol钠离子和0.1mol硫酸氢根离子即共0.2mol,即0.2NA个,故A错误;
B、铵根离子是弱碱阳离子,在溶液中会水解,故溶液中的铵根离子的个数小于0.1NA个,故B错误;
C、7.8g过氧化钠的物质的量为0.1mol,而1mo过氧化钠与二氧化碳反应转移1mol电子,故0.1mol过氧化钠转移0.1mol电子即0.1NA个,故C正确;
D、I-的还原性强于Fe2+,故向0.2molFeI2的溶液中持续通入氯气,氯气先与I-反应,待I-反应完后,氯气再与Fe2+反应.故当由0.1molFe2+被氧化时,说明0.4molI-已被氧化完全,消耗氯气0.2mol.而氧化0.1molFe2+又需氯气0.05mol,故共需氯气0.25mol,在标况下C12体积为5.6L,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.


科目:高中化学 来源: 题型:解答题
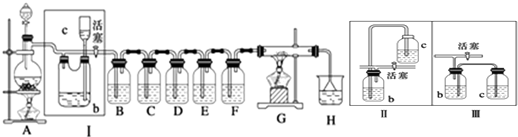
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molCl2与足量Fe反应,转移的电子数为3NA | |
| B. | 1.5molNO2与足量H2O反应,转移的电子数为1.5NA | |
| C. | 常温常压下,46gNO2和N2O4混合气体含有的原子数为3NA | |
| D. | 含有H2SO41mol的浓硫酸与足量铜反应,生成SO2的分子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
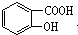 ,请回答下列问题:
,请回答下列问题: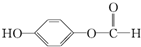 .
. ,1mol该有机物在适宜条件下与氢氧化钠经过一系列反应,最多能消耗氢氧化钠的物质的量为(填序号)C;
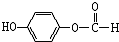
,1mol该有机物在适宜条件下与氢氧化钠经过一系列反应,最多能消耗氢氧化钠的物质的量为(填序号)C;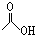 ,在一定条件下,水杨酸与乙酸酐可合成阿斯匹林,阿斯匹林可表示为:
,在一定条件下,水杨酸与乙酸酐可合成阿斯匹林,阿斯匹林可表示为: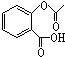 ,则阿斯匹林的分子式为C9H8O4.
,则阿斯匹林的分子式为C9H8O4.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
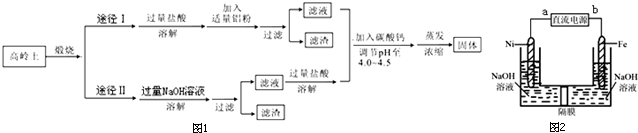
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | abdi | B. | cefk | C. | fghl | D. | bcegj |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| X | |
| Y | Z |
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com