
在金属晶体中,如果金属原子的价电子数越多,原子半径越小,自由电子与金属阳离子间的作用力越大,金属的熔沸点越高,由此判断下列各组金属熔沸点高低顺序,正确的是
A.Mg>Al>Ca B.Al>Na>Li C.Al>Mg>Ca D.Mg>Ba>Al
科目:高中化学 来源:2016届广东省顺德市高三上第四次月考理综化学试卷(解析版) 题型:填空题
咖啡酸(如图)存在于野胡萝卜、光叶水苏、荞麦等物中。咖啡酸有止血作用,特别对内脏的止血效果较好。
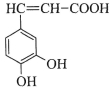
(1)咖啡酸的化学式_______。
咖啡酸中含氧官能团的名称________。
(2)咖啡酸发生加聚反应所得产物的结构简式_______。
(3)下列关于咖啡酸的说法正确的是_____:
A.1mol咖啡酸最多只能与1molBr2反应
B.咖啡酸和乙醇能发生酯化反应
C.咖啡酸遇氯化铁溶液能发生显色反应
D.只用KMnO4溶液即可检验咖啡酸分子中含有碳碳双键
(4)咖啡酸与足量NaOH溶液反应的化学方程式:_________
(5)A是咖啡酸的同分异构体,其苯环上只有1个取代基,1molA能与2molNaHCO3反应,A的结构简式__________。
查看答案和解析>>
科目:高中化学 来源:2016届湖南省高三上学期月考化学试卷(解析版) 题型:选择题
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:xA(g)+B(g)  2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和下图表示
2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和下图表示
容器 | 甲 | 乙 | 丙 |
容积 | 0.5L | 0.5L | 1. 0L |
温度/℃ | T1 | T2 | T2 |
反应物 起始量 | 1.5molA 0.5 molB | 1.5 molA 0.5 molB | 6.0 molA 2.0 molB |

下列说法正确的是
A.l0min内甲容器中反应的平均速率v(A)=0.025mol·(L·min)-1
B.由图可知:T1<T2,且该反应为吸热反应
C.若平衡时温度不变,改变容器体积平衡不移动
D.T1℃,起始时甲容器中充入0.5molA、1.5molB,平衡时A的转化率为25%
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南省高二上第三次月考化学试卷(解析版) 题型:选择题
对于常温下pH为1的硝酸溶液,下列叙述正确的是
A.该溶液1 mL稀释至100 mL后,pH等于3
B.向该溶液中加入pH为13的氢氧化钡溶液恰好完全中和
C.该溶液中硝酸电离出的c(H+)与水电离出的c(H+)之比值为10-12
D.该溶液中水电离出的c(H+)是pH为3的硝酸中水电离出的c(H+)的100倍
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高二上期中考试化学试卷(解析版) 题型:选择题
浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随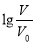 的变化如图所示,下列叙述错误的是
的变化如图所示,下列叙述错误的是

A.MOH的碱性强于ROH的碱性
B.ROH的电离程度:b点大于a点
C.若两溶液无限稀释,则它们的c(OH-)相等
D.当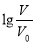 =2时,若两溶液同时升高温度,则
=2时,若两溶液同时升高温度,则 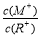 增大
增大
查看答案和解析>>
科目:高中化学 来源:2016届吉林省高三上四次模拟化学卷(解析版) 题型:填空题
某化工厂以软锰矿、闪锌矿(主要成分为MnO2、ZnS,还含有少量的FeS、CuS、Al2O3等物质)为原料制取Zn和MnO2。
(1)在一定条件下,将这两种矿粉在硫酸溶液中相互作用,可得到含有Mn2+、Fe3+、Cu2+、Al3+、Zn2+的酸性溶液,其中发生的主要反应之一如下,请配平此反应方程式:_____MnO2+_____FeS+_____H2SO4=_____MnSO4+_____Fe2(SO4)3+_____S+_____H2O
(2)将所得溶液按以下的工业流程(如图I)进行操作处理得溶液(IV),电解溶液(IV)即得MnO2和Zn.
 图(Ⅰ)
图(Ⅰ)
a.操作①中加Zn粉后发生反应的离子方程式为_________________;
b.操作②中加入适量X的作用是_________________;
c.工业上用惰性电极电解溶液(IV)获得产品,请写出电解过程中的阳极反应式_________________;
(3)为了从上述流程中产生的Fe(OH)3、Al(OH)3沉淀混合物中回收Al(OH)3,工厂设计了如下的有关流程如图(Ⅱ)。
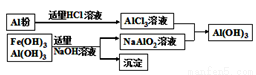 图(Ⅱ)
图(Ⅱ)
a.AlCl3溶液和NaAlO2溶液反应生成Al(OH)3的离子方程式为_________________;
b.若得到n molAl(OH)3,则理论上消耗的NaOH和HCl的物质的量分别为___________、__________;
查看答案和解析>>
科目:高中化学 来源:2016届宁夏固原一中高三上适应性训练理综化学试卷(解析版) 题型:实验题
亚氯酸钠(NaClO2)是重要漂白剂,探究小组开展如下实验,回答下列问题:
实验Ⅰ:制取NaClO2晶体按如下图装置进行制取。
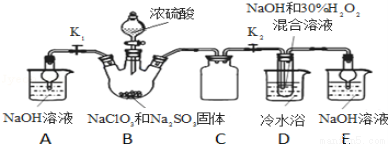
已知:NaClO2饱和溶液在低于38℃时析出NaClO2•3H2O,高于38℃时析出NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
(1)装置C的作用是 ;
(2)已知装置B中的产物有ClO2气体,则装置B中反应的方程式为 ;装置D中反应生成NaClO2的化学方程式为 ;反应后的溶液中阴离子除了ClO2﹣、ClO3﹣、Cl﹣、ClO﹣、OH﹣外还可能含有的一种阴离子是 ;检验该离子的方法是 ;
(3)如果撤去D中的冷水浴,可能导致产品中混有的杂质是 ;
实验Ⅱ:样品杂质分析与纯度测定
(4)测定样品中NaClO2的纯度.测定时进行如下实验:
①准确称取所得亚氯酸钠样品m g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(已知:ClO2-+4I-+4H+=2H2O+2I2+Cl-);将所得混合液配成250 mL待测溶液。
②移取25.00 mL待测溶液于锥形瓶中,加几滴淀粉溶液,用c mol·L-1 Na2S2O3标准液滴定,至滴定终点。重复2次,测得平均值为V mL(已知:I2+2S2O32-=2I-+S4O62-)。
达到滴定终点时的现象为________________。该样品中NaClO2的质量分数为____________(用含m、c、V的代数式表示)。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省宜春市高一上学期第三次月考化学试卷(解析版) 题型:选择题
下列有关碳酸钠和碳酸氢钠的说法不正确的是
A.在水中的溶解度:碳酸钠>碳酸氢钠
B.热稳定性:碳酸钠>碳酸氢钠
C.等物质的量的碳酸钠和碳酸氢钠分别与足量的盐酸反应,两者产生二氧化碳一样多
D.足量的碳酸钠和碳酸氢钠分别与等物质的量的盐酸反应,两者产生二氧化碳一样多
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广西省高二上段考文化学试卷(解析版) 题型:选择题
下列关于1.5 mol 氢气的叙述中,正确的是
A.质量是 4 g B.体积是 33.6 L
C.电子数是 3 D.分子数是 1.5×6.02 ×1023 个
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com