
【题目】(一)A、B、C、D、E、X是中学常见的无机物,存在如图转化关系(部分生成物和反应条件略去)。

(1)若A为常见的金属单质,且其焰色反应呈黄色,X能使品红溶液褪色,写出C和E反应的离子方程式:___。
(2)若A为短周期元素组成的单质,该元素的最高价氧化物的水化物酸性最强,则X可能为__(填字母)。
a.NaHCO3 b.Na2CO3 c.Al(OH)3 d.NaAlO2
(3)若A为淡黄色粉末,则A的电子式为___。若X为一种最常见的造成温室效应的气体。则鉴别等浓度的D、E两种溶液,可选择的试剂为___。(填字母)
a.盐酸 b.CaCl2溶液 c.氨水 d.澄清石灰水
(二)工业废水中仅含下表离子中的5种(不考虑水的电离及离子的水解),且各种离子的物质的量浓度均为0.1mol![]() L-1。
L-1。
阳离子 | K+、Cu2+、Fe3+、Al3+、Fe2+ |
阴离子 | Cl-、CO32-、NO3-、SO42-、SiO32- |
某同学欲探究该废水的组成,进行了如下实验:
Ⅰ.用铂丝蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察)。
Ⅱ.取少量溶液,加入KSCN溶液无明显变化。
Ⅲ.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变。
Ⅳ.向Ⅲ 中所得溶液中加入BaCl2溶液,有白色沉淀生成。
请回答下列问题:
(1)甲同学最终确定原溶液中所含阳离子有___,阴离子是有___。(写离子符号)
(2)Ⅲ中加入少量盐酸生成无色气体的离子方程式为___。
(3)另取100mL原溶液,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,得到的固体的质量为__g。
【答案】OH-+HSO3-=SO32-+H2O b ![]() ab Fe2+、Cu2+ Cl-、NO3-、SO42- 3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O 1.6
ab Fe2+、Cu2+ Cl-、NO3-、SO42- 3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O 1.6
【解析】
(一)、(1)若A为常见的金属单质,焰色反应呈黄色,则A为Na,Na和水反应生成NaOH和氢气,X能使品红溶液褪色,则X是SO2,C为NaOH,B为H2,D能和SO2反应,则D是Na2SO3、E是NaHSO3;
(2)若A为短周期元素组成的单质,该元素的最高价氧化物的水化物酸性最强,A是Cl2,氯气和水反应生成HCl和HClO,C和X反应生成D、D能和X反应生成E,盐酸能和碳酸钠、亚硫酸钠反应且是两步反应;
(3)若A为淡黄色粉末,且能和水反应,则A为Na2O2,若X为一种造成温室效应的气体,X是CO2,过氧化钠和水反应生成NaOH和氧气,NaOH和CO2反应先生成Na2CO3,二氧化碳过量时生成NaHCO3;
(二)、用铂丝蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察),判断无钾离子;取少量溶液,加入KSCN溶液无明显变化,无三价铁离子;另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,判断红棕色气体为二氧化氮,无色气体为一氧化氮;此时溶液依然澄清,推断溶液中含有NO3-和Fe2+;且溶液中阴离子种类不变,各离子的物质的量均为0.1mol,根据电荷守恒可知还应含有Cu2+,若向原溶液中加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,得到的固体是氧化铁和氧化铜,根据铁原子、铜原子守恒计算固体质量,根据反应3Fe2++4H++NO3-=3Fe3++NO↑+2H2O的离子方程式计算相关物理量。
(一)、(1)若A为常见的金属单质,焰色反应呈黄色,则A为Na,Na和水反应生成NaOH和氢气,X能使品红溶液褪色,则X是SO2,C为NaOH,B为H2,D能和SO2反应,则D是Na2SO3、E是NaHSO3;C是NaOH,E是亚硫酸氢钠,二者反应离子方程式为OH-+HSO3-=SO32-+H2O,故答案为:OH-+HSO3-=SO32-+H2O;
(2)若A为短周期元素组成的单质,该元素的最高价氧化物的水化物酸性最强,A是Cl2,氯气和水反应生成HCl和HClO,C和X反应生成D、D能和X反应生成E,盐酸能和碳酸钠、亚硫酸钠反应且是两步反应,通过以上分析知,X可能为Na2CO3、Na2SO3,故选b;答案为:b;
(3)若A为淡黄色粉末,且能和水反应,则A为Na2O2,Na2O2的电子式为![]() ,若X为一种造成温室效应的气体,D是碳酸钠、E是碳酸氢钠,可以用盐酸、氯化钙检验碳酸钠、碳酸氢钠,故选ab;故答案为:
,若X为一种造成温室效应的气体,D是碳酸钠、E是碳酸氢钠,可以用盐酸、氯化钙检验碳酸钠、碳酸氢钠,故选ab;故答案为:![]() ;ab;
;ab;
(二)、(1)若向溶液中加入KSCN溶液,无明显变化,说明原溶液中不含Fe3+;若向溶液中加入过量的盐酸,有气体生成,溶液中阴离子种类不变,说明原溶液中含有Cl-,该气体只能是NO,说明含有具有氧化性的NO3-和还原性的Fe2+,若向溶液中加入BaCl2溶液,有白色沉淀生成,说明原溶液中含有SO42-,各离子的物质的量均为0.1mol,根据电荷守恒可知还应含有Cu2+,所以原溶液中所含阳离子是Fe2+、Cu2+;阴离子是NO3-、Cl-、SO42-,故答案为:Fe2+、Cu2+;NO3-、Cl-、SO42-;
(2))Ⅲ中加入少量盐酸生成无色气体,是Fe2+与NO3-和H+反应生成NO,其离子方程式:3Fe2++NO3-+4H+═3Fe3++NO+2H2O;故答案为:3Fe2++NO3-+4H+═3Fe3++NO+2H
(3)原溶液中所含阳离子是Fe2+、Cu2+,若向原溶液中加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,得到的固体是CuO、Fe2O3,根据题意各离子的物质的量均为0.01mol可知m(CuO)=0.01mol×80g/mol=0.8g,m(Fe2O3)=![]() ×0.01mol×160g/mol=0.8g,所得固体的质量为0.8g+0.8g=1.6g,故答案为:1.6。
×0.01mol×160g/mol=0.8g,所得固体的质量为0.8g+0.8g=1.6g,故答案为:1.6。


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
【题目】某课外小组设计了下图所示的实验装置(图中固定装置已略去),进行SO2性质的研究。
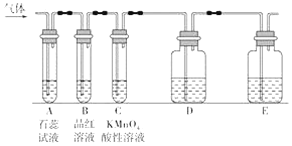
(1)从物质分类的角度,SO2属于____(填“酸性”或“碱性”)氧化物。
①图中D装置可用来验证SO2具有该性质,其中所加入的试剂是________________。
②当向该装置通入SO2时,A中实验现象为_________,用化学用语解释其原因___________。
(2)从元素化合价的角度分析,SO2具有___性。
①当向该装置通入SO2一段时间后,可观察C中实验现象为___,说明SO2具有_____性。
②如验证SO2还具有另一方面的性质,可选择的药品是___,实验现象__________。
A.过氧化氢 B.浓硫酸C.氯水 D.硫化钠溶液
(3)B中的品红溶液现象是___________,证明SO2具有_________性。
(4)多余的SO2一般用氢氧化钠溶液吸收,反应的离子方程式_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化工原料1,![]() 二苯基
二苯基![]() ,
,![]() 丁二烯及某抗结肠炎药物有效成分的合成路线如图
丁二烯及某抗结肠炎药物有效成分的合成路线如图![]() 部分反应略去试剂和条件
部分反应略去试剂和条件![]() :
:
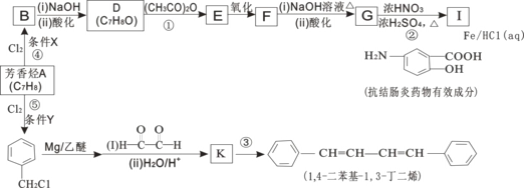
已知:
Ⅰ.R-Cl![]() RMgCl
RMgCl![]()
Ⅱ. ![]()
![]()
![]()
Ⅲ. ![]()
![]()
![]()
Ⅳ. ![]()
![]()
![]()
![]() 抗结肠炎药物有效成分分子中的含氧官能团名称是__________。
抗结肠炎药物有效成分分子中的含氧官能团名称是__________。
![]() 的结构简式是 _______________。
的结构简式是 _______________。
![]() 写出F与NaOH反应的化学方程式 _____________。
写出F与NaOH反应的化学方程式 _____________。
![]() 下列说法正确的是________
下列说法正确的是________![]() 填选项字母
填选项字母![]() 。
。
A ![]() 的反应条件X和
的反应条件X和![]() 的反应条件Y完全相同
的反应条件Y完全相同
B ![]() 反应类型相同
反应类型相同
C G不可以发生缩聚反应
D 设计![]() 和
和![]() 两步反应的目的是防止酚羟基被氧化
两步反应的目的是防止酚羟基被氧化
![]() 的化学方程式是___________。
的化学方程式是___________。
![]() 有多种同分异构体,符合下列条件的同分异构体有 ___________种。
有多种同分异构体,符合下列条件的同分异构体有 ___________种。
![]() 结构中有苯环
结构中有苯环 ![]() 与E有相同的官能团
与E有相同的官能团 ![]() 不能发生银镜反应
不能发生银镜反应
![]() ,
,![]() 二苯基
二苯基![]() ,
,![]() 丁二烯有多种同分异构体,写出符合下列条件的同分异构体的结构简式___________________。
丁二烯有多种同分异构体,写出符合下列条件的同分异构体的结构简式___________________。
![]() 结构中有两个苯环,无其它环状结构。
结构中有两个苯环,无其它环状结构。
![]() 苯环上的一硝基取代产物有两种。
苯环上的一硝基取代产物有两种。
![]() 其核磁共振氢谱有3种峰,峰面积之比为
其核磁共振氢谱有3种峰,峰面积之比为![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请写出电子式
(1)原子的电子式
H____ 、Ca ____、N____、 O____、 Cl____ 、C____ 、 Al____
(2)离子的电子式
①简单阳离子:氢离子____ 钾离子____ 钙离子____
②简单阴离子:氯离子____ 氧离子____
③复杂阴、阳离子:铵根离子____ 氢氧根离子____ 过氧根离子(![]() )____
)____
(3)离子化合物的电子式
NaCl____ CaO____ CaCl2_____ CaF2 ____ Na2O ____ Na2O2____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Y 是一种天然除草剂,其结构如图所示,下列说法正确的是( )
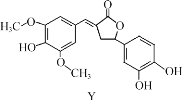
A.Y 可以和NaHCO3 溶液发生反应
B.Y 分子中所有碳原子一定在同一平面内
C.1 mol Y 最多能与 6 mol NaOH 反应
D.Y 与足量的H2加成反应的产物含 7 个手性碳原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了研究有机物A的组成与结构,某同学进行如下实验。
i.将9.0gA 在足量氧气中充分燃烧,并使其产物依次缓缓通过足量的浓硫酸和碱石灰,发现两者分别增重5.4g和13.2g。
ii.通过质谱法测得其相对分子质量为90。
ili.通过红外光谱法测得A中含有—OH和—COOH。
请回答下列问题。
(1)9.0gA完全燃烧生成水的物质的量是____________mol。
(2)A的实验式是____________。
(3)A的分子式是____________。
(4)在一定条件下,若两个A分子可以反应得到一个六元环的分子,则A的结构简式是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的双液原电池,下列叙述正确的是( )
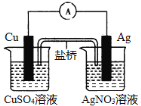
A.Cu为电池负极
B.Ag电极上发生氧化反应
C.盐桥中的阳离子向左池移动
D.外电路中,电流从Cu电极流向Ag电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环戊二烯可用于制备二茂铁(Fe(C5H5)2,结构简式为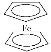 ),后者广泛应用于航天、化工等领域中。二茂铁的电化学制备原理如图所示,其中电解液为溶解有溴化钠(电解质)和环戊二烯的DMF溶液(DMF为惰性有机溶剂)。下列说法错误的是( )
),后者广泛应用于航天、化工等领域中。二茂铁的电化学制备原理如图所示,其中电解液为溶解有溴化钠(电解质)和环戊二烯的DMF溶液(DMF为惰性有机溶剂)。下列说法错误的是( )
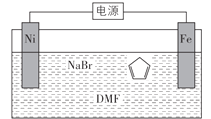
A.制备二茂铁总反应为:Fe+2![]() =
=![]() +H2↑
+H2↑
B.电解制备需要在无水条件下进行
C.Ni电极与电源负极连接
D.阳极电极反应为:2Br--2e-=Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)从绿色化学、环保的角度选择制取硫酸铜的原料________。
a.Cu b.CuO
c.CuS d.Cu(OH)2·CuSO4
(2)写出从硫酸铜溶液中得到硫酸铜晶体的操作:________、________、过滤、洗涤……
(3)如图球形管装置的作用:_________________________________________。
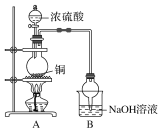
(4)反应后溶液中存在Cu2+,但浓硫酸有吸水性,不能通过溶液颜色来判断Cu2+的存在,请写出一种简便的方法验证Cu2+的存在:_________________________________________________________________。
(5)在实际反应中,由于条件控制不好,容易产生CuS和Cu2S固体。
已知:2CuS![]() Cu2S+S。取a g固体样品(只含CuS和Cu2S),加热后测得Cu2S固体质量为b g,求固体样品中CuS质量分数________:若Cu2S在高温下会分解为Cu,则测得CuS的质量分数________(偏大、偏小或不变)。
Cu2S+S。取a g固体样品(只含CuS和Cu2S),加热后测得Cu2S固体质量为b g,求固体样品中CuS质量分数________:若Cu2S在高温下会分解为Cu,则测得CuS的质量分数________(偏大、偏小或不变)。
(6)根据以上信息,说明Cu与浓硫酸反应需要控制哪些因素:________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com