
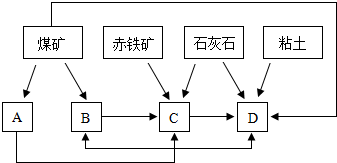
��ҵ����������ʱ,���ô�������Ӧ��SO2ת��ΪSO3��һ���ؼ����衣ѹǿ���¶ȶ�SO2ת���ʵ�Ӱ�����±�(ԭ�������ɷֵ��������Ϊ��SO2 7%,O2 11%,N2 82%)��

(1)��֪SO2�������Ƿ��ȷ�Ӧ��������ñ��������ƶϴ˽��ۣ�
_____________________________________________________________________
(2)��400~500 ��ʱ��SO2�Ĵ��������ó�ѹ�����Ǹ�ѹ����Ҫԭ���ǣ�___________��
(3)ѡ�����˵Ĵ������Ƿ�������SO2��ת���ʣ�___________(��ǡ���)���Ƿ��������÷�Ӧ���ų���������___________(��ǡ���)��
(4)Ϊ���SO3�����ʣ�ʵ����������___________����SO3��
(5)��֪��2SO2(g)+O2(g)===2SO3(g) ��H=��196.6 kJ��mol��1������ÿ����1���98%��������Ҫ��SO3��������SO2������ЩSO3���ų���������
��1��ѹǿһ��ʱ,�¶�����ʱ,SO2ת�����½�,˵�����������淴Ӧ�Ľ���,��������ӦΪ���ȷ�Ӧ��
��2������ѹǿ�����SO2ת����������Ӱ�죬���������ӳɱ���
��3���� ��
��4��Ũ����
��5��8.0��103t ��9.83��109KJ
��1�������б������ݿ��Կ���ͬһѹǿ�²��������¶ȣ�SO2��ת���ʲ��Ͻ��ͣ�˵�����淴Ӧ2SO2(g)��O2(g) ![]() 2SO3(g)����Ϊ���ȷ�Ӧ��
2SO3(g)����Ϊ���ȷ�Ӧ��
��2���ӱ������ݿ��Կ���400~500�棬10Mpaʱ��SO2��ת����Ϊ99.3%~99.9%�����dz�ѹ��SO2��ת�����Ѿ��ܸߣ�ѹǿ����100����ת������ߵIJ������ԣ�������Ҫ�����豸ǿ�ȣ�����Ͷ�ʣ�������ҵ����Ч�档
��3�������������̴ﵽƽ���ʱ�䣬��������ʹƽ�ⷢ���ƶ����ʲ������SO2��ת���ʣ�Ҳ��������Ӧ�ų���������
��4����ΪSO3 + H2O�� H2SO4�÷�Ӧ�ų��������ȣ�������������ֹSO2�����գ�ʵ����������98.3%��ŨH2SO4����SO3��
��5���⣺1���98%�����ẬH2SO4��������9.8��109g
����ҪSO3������Ϊx���÷�Ӧ����������Ϊy��
H2SO4 ��SO2 ����H
98g 80g ��196.6��0.5KJ
9.8��109g x y
X=��9.8��109g��80g����98g=8.0��109g=8.0��103t
Y=8.0��103t��98.3KJ��80g=9.83��109KJ


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| 1 | 2 |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
|
ѹǿ/MPa SO2ת���� �¶�/�� |
0.1 |
0.5 |
1 |
10 |
| 400 | 99.2% | 99.6% | 99.7% | 99.9% |
| 500 | 93.5% | 96.9% | 97.8% | 99.3% |
| 600 | 73.7% | 85.8% | 89.5% | 96.4% |
| ||
| �� |
| ||
| ||
| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| ѹǿ/Mpa ת����/% �¶�/�� |
0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 | 93.5 | 96.9 | 97.8 | 99.3 |
| 600 | 73.7 | 85.8 | 89.5 | 96.4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2007����ͨ�ߵ�ѧУ����ͳһ�������ۻ�ѧ���֣����ľ��� ���ͣ�������
��ҵ����������ʱ,���ô�������Ӧ��SO2ת��ΪSO3��һ���ؼ����衣ѹǿ���¶ȶ�SO2ת���ʵ�Ӱ�����±�(ԭ�������ɷֵ��������Ϊ��SO2 7%,O2 11%,N2 82%)��
(1)��֪SO2�������Ƿ��ȷ�Ӧ��������ñ��������ƶϴ˽��ۣ�
_____________________________________________________________________
(2)��400~500 ��ʱ��SO2�Ĵ��������ó�ѹ�����Ǹ�ѹ����Ҫԭ���ǣ�___________��
(3)ѡ�����˵Ĵ������Ƿ�������SO2��ת���ʣ�___________(��ǡ���)���Ƿ��������÷�Ӧ���ų���������___________(��ǡ���)��
(4)Ϊ���SO3�����ʣ�ʵ����������___________����SO3��
(5)��֪��2SO2(g)+O2(g)===2SO3(g) ��H=��196.6 kJ��mol��1������ÿ����1���98%��������Ҫ��SO3��������SO2������ЩSO3���ų���������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com