
| A.SiH4的沸点高于CH4,可推测PH3的沸点高于NH3 |
| B.NH为正四面体结构,可推测PH也为正四面体结构 |
| C.CO2晶体是分子晶体,可推测SiO2晶体也是分子晶体 |
| D.C2H6是碳链为直线形的非极性分子,可推测C3H8也是碳链为直线形的非极性分子 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
| Na2O | Na | AlF3 | AlCl3 | Al2O3 | BCl3 | CO2 | SiO2 |
| 920 ℃ | 97.8 ℃ | 1291 ℃ | 190 ℃ | 2073 ℃ | -107 ℃ | -57 ℃ | 1723 ℃ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
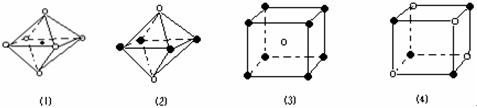
| A.图⑴和图⑶ | B.图⑵和图⑶ | C.只有图⑴ | D.图⑴和图⑷ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
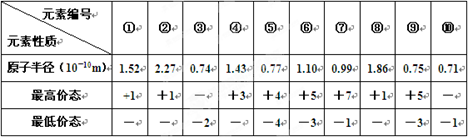
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.H2O2分子中,两个O之间形成2对共用电子对 |
| B.N2的电子式是N┇┇N |
| C.CO2和CS2都是直线型分子 |
| D.白磷和甲烷都是正四面体型,键角都是109°28′ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
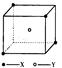
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

A.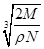 cm cm | B.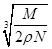 cm cm | C.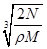 cm cm | D.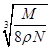 cm cm |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.氯化铯晶体中,每个Cs+周围紧邻8个Cl- |
| B.氯化钠晶体中,每个Na+周围距离最近且相等的Na+共有6个 |
| C.干冰晶体中,每个CO2分子周围紧邻12个CO2分子 |
| D.金刚石为网状结构,由共价键形成的碳原子环中,最小环上有6个碳原子 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
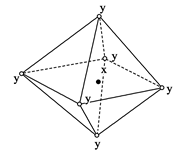
| A.NaCl(x=Na+,y=Cl-) |
| B.CsCl(x=Cs+,y=Cl-) |
| C.金属钋(Po) |
| D.MgO晶体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com