
科目:高中化学 来源: 题型:


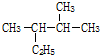
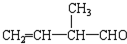 含氧官能团的名称是
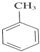
含氧官能团的名称是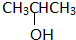
 +3HNO3
+3HNO3
| ||
| 加热 |
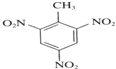 +3H2O.
+3H2O. +3HNO3
+3HNO3
| ||
| 加热 |
 +3H2O.
+3H2O.| 加热 |
| 加热 |
| 醇 |
| 加热 |
| 醇 |
| 加热 |
| 加热 |
| 加热 |


查看答案和解析>>
科目:高中化学 来源: 题型:

| 催化剂 |

| 催化剂 |

 +3H2
+3H2
 +3H2
+3H2
查看答案和解析>>
科目:高中化学 来源: 题型:
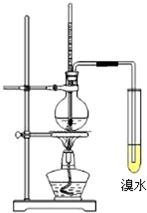 实验室制取乙烯并进行乙烯性质实验的装置如图所示.
实验室制取乙烯并进行乙烯性质实验的装置如图所示.查看答案和解析>>
科目:高中化学 来源:2013-2014学年云南省部分名校高三12月统一考试理综化学试卷(解析版) 题型:填空题
下面涉及的是工业生产硝酸铵的过程。
(1)写出NO2和水反应的化学方程式,并标出电子转移的方向和数目。 。
(2)已知:
4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H= 一1266.8kJ/mol
N2(g)+O2(g)=2NO(g) △H= +180.5 kJ/mol
写出氨高温催化氧化的热化学方程式: ,
氨催化氧化生成NO反应的化学平衡常数表达式K= 。
(3)已知:N2(g)+3H2(g)
 2NH3(g) △H=-92 kJ/mol。为提高氢气的转化率,宜采取的措施有 。(填字母)
2NH3(g) △H=-92 kJ/mol。为提高氢气的转化率,宜采取的措施有 。(填字母)
A.升高温度 B.使用催化剂
C.及时移出氨 D.循环利用和不断补充氮气
(4)在一定温度和压强下,将H2和N2按3:1(体积比)在密闭容器中混合,当该反应达到平衡时,测得平衡混合气中NH3的气体体积分数为17.6%,此时H2的转化率为 。
(5)许多有机物在特定的装置内进行氧化的同时还可产生电能,这种装置即为燃料电池。
例如,乙烯被氧化生成乙醛的化学反应:2CH2=CH2 + O2 →2CH3CHO可设计成燃料电池:
正极为:O2+4H++4e-=2H2O 负极为:
电池工作时,负极附近溶液的pH (填“升高”、“降低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源:2014届浙江省高一3月月考实验班化学试卷(解析版) 题型:填空题
(11分)2005年的诺贝尔化学奖颁给了3位在烯烃复分解反应研究方面做出突出贡献的化学家。烯烃复分解反应实际上是在金属烯烃络合物的催化下实现C=C双键两边基团换位的反应。如下图表示了两个丙烯分子进行烯烃换位,生成两个新的烯烃分子——丁烯和乙烯。

现以石油裂解得到的丙烯为原料,经过下列反应可以分别合成重要的化工原料I和G。I和G在不同条件下反应可生成多种化工产品,如环酯J。
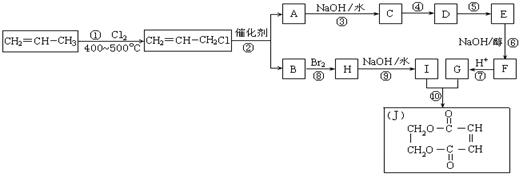
请按要求填空:
(1)写出下列反应的反应类型:①:_________,⑥:__________,⑧:_____________
(2)反应②的化学方程式是___________________________________________。
(3)反应④、⑤中有一反应是与HCl加成,该反应是________(填反应编号),设计这一步反应的目的是 ,物质E的结构简式是_______________。
(4)反应⑩的化学方程式是___________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com