
下列文字表述与反应方程式对应且正确的是( )
A.氧化铁溶于氢碘酸:Fe2O3+6H+===2Fe3++3H2O
B.含等物质的量的KHCO3和Ba(OH)2溶液混合:
HCO +Ba2++OH-===BaCO3↓+H2O
+Ba2++OH-===BaCO3↓+H2O
C.向氯化铝溶液中加入过量氨水:Al3++4NH3·H2O===AlO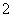 +4NH
+4NH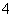 +2H2O
+2H2O
D.硫化钠水溶液呈碱性:S2-+H2O HS-+OH-
HS-+OH-
科目:高中化学 来源: 题型:
碳、硫的含量影响钢铁性能。碳、硫含量的一种测定方法是将钢样中的碳、硫转化为气体,再用测碳、测硫装置进行测定。
(1)采用装置A,在高温下将x g钢样中的碳、硫转化为CO2、SO2。

①气体a的成分是______。
②若钢样中硫以FeS形式存在,A中反应:
3FeS+5O2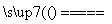 1________+3________。
1________+3________。
(2)将气体a通入测硫装置中(如图),采用滴定法测定硫的含量。
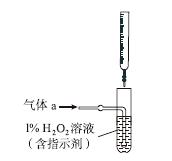
①H2O2氧化SO2的化学方程式:__________________。
②用NaOH溶液滴定生成的H2SO4,消耗z mL NaOH溶液。若消耗1 mL NaOH溶液相当于硫的质量为y g,则该钢样中硫的质量分数:________。
(3)将气体a通入测碳装置中(如图),采用重量法测定碳的含量。
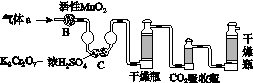
①气体a通过B和C的目的是________________________________________。
②计算钢样中碳的质量分数,应测量的数据是_______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
化学反应的实质是“旧键的断裂和新键的形成”。在一定条件下,一个乙醇分子断键只失去两个氢原子,生成的新有机化合物可能有(写结构简式,不一定填满)_______________;__________;______________;________________。根据你学习过的知识和提供的试剂、仪器,实现上述某一种转化,并验证该转化后的有机化合物。试剂:无水乙醇、光亮的铜丝、氢氧化钠溶液、硫酸铜溶液。仪器:试管、试管夹、镊子、胶头滴管、酒精灯、火柴。
(1)乙醇的转化:
①实验方案是_____________________________________;
②实验现象是_____________________________________;
③乙醇转化的化学方程式________________________。
(2)产物的验证:
①决定该有机化合物的主要性质的原子团的结构式是________,名称是______________。
②已知结构相似的物质,具有相似的化学性质。试用这一原理验证由乙醇转化成的有机物:首先配制试剂(写试剂名称)__________ _,然后将该试剂与被验证的有机化合物混合,并加热至沸腾,观察到的现象是______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
现有常温下的四种溶液(如下表),下列有关叙述中正确的是
| ① | ② | ③ | ④ | |
| 溶液 | 氨水 | 氢氧化钠 | 醋酸 | 盐酸 |
| pH | 11 | 11 | 3 | 3 |
A.分别加水稀释10倍,四种溶液的pH为①>②>④>③
B.温度上升10℃,四种溶液的pH均不变(不考虑挥发与分解)
C.在③④中分别加入适量的醋酸铵晶体后,③的pH减小,④的pH不变
D.将①④两种溶液等体积混合,所得溶液中c(Cl-)>c(NH4+)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
铁是地壳中含量第二的金属元素,其单质、合金及化合物在生产生活中的应用广泛。
(一)工业废水中含有一定量的Cr2O72−和CrO42−,它们会对人类及生态系统产生很大的危害,必须进行处理。常用的处理方法是电解法,该法用Fe作电极电解含Cr2O72−的酸性废水,随着电解的进行,阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(1)用Fe作电极的目的是_______________________________。
(2)阴极附近溶液pH升高的原因是_______________________________(用电极反应式解释);溶液中同时生成的沉淀还有________________。
(二)氮化铁磁粉是一种磁记录材料,利用氨气在400℃以上分解得到的氮原子渗透到高纯铁粉中可制备氮化铁。制备高纯铁粉涉及的主要生产流程如下:
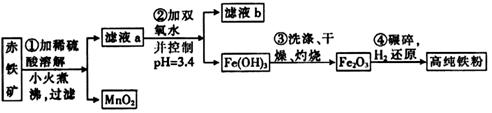
已知:①某赤铁矿石含60.0%Fe2O3、3.6%FeO,还含有Al2O3、MnO2、CuO等。
②部分阳离子以氢氧化物形式完全沉淀时溶液的pH如下:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 6.7 |
(3)步骤②中加双氧水的目的是_________________________,pH控制在3.4的作用是_____________________________;已知25℃时,Ksp[Cu(OH)2]=2.0×10-20,该温度下反应:Cu2++2H2O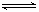 Cu(OH)2+2H+的平衡常数K=_______________。
Cu(OH)2+2H+的平衡常数K=_______________。
(4)制备氮化铁的反应:Fe+NH3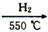 FexNy+H2(未配平),若整个过程中消耗氨气34.0g,消耗赤铁矿石2kg,设整个过程中无损耗,则FexNy磁粉的化学式为___________。
FexNy+H2(未配平),若整个过程中消耗氨气34.0g,消耗赤铁矿石2kg,设整个过程中无损耗,则FexNy磁粉的化学式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
能大量共存于同一溶液中,且当溶液中加入过量的NaOH溶液或少量稀硫酸时,都能产生白色沉淀的离子组是( )
A.Ba2+、Mg2+、NO 、CO
、CO B.H+、Ba2+、Al3+、Cl-
B.H+、Ba2+、Al3+、Cl-
C.K+、Ba2+、Cl-、HCO D.NH
D.NH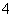 、Ba2+、Fe3+、Cl-
、Ba2+、Fe3+、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式正确的是( )
A.铝片与NaOH溶液反应:Al+2OH-===AlO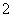 +H2↑
+H2↑
B.稀硝酸中加入少量碳酸亚铁:FeCO3+2H+===Fe2++CO2↑+H2O
C.饱和碳酸钠溶液中通入二氧化碳气体:2Na++CO +CO2+H2O===2NaHCO3↓
+CO2+H2O===2NaHCO3↓
 D.Ba(OH)2与过量的NH4HSO4反应:Ba2++2OH-+2H++SO
D.Ba(OH)2与过量的NH4HSO4反应:Ba2++2OH-+2H++SO ===BaSO4↓+2H2O
===BaSO4↓+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
离子液体是一种室温熔融盐,为非水体系。由有机阳离子、Al2Cl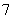 和AlCl
和AlCl 组成的离子液体作电解液时,可在钢制品上电镀铝。
组成的离子液体作电解液时,可在钢制品上电镀铝。
(1)钢制品接电源的________极,已知电镀过程中不产生其他离子且有机阳离子不参与电极反应,阴极电极反应式为__________________________________________。若改用AlCl3水溶液作电解液,则阴极产物为________。
(2)为测定镀层厚度,用NaOH溶液溶解钢制品表面的铝镀层,当反应转移6 mol电子时,所得还原产物的物质的量为________mol。
(3)用铝粉和Fe2O3做铝热反应实验,需要的试剂还有________。
a.KCl b.KClO3 c.MnO2 d.Mg
取少量铝热反应所得的固体混合物,将其溶于足量稀H2SO4,滴加KSCN溶液无明显现象,______________(填“能”或“ 不能”)说明固体混合物中无Fe2O3,理由是________(用离子方程式说明)。
查看答案和解析>>
科目:高中化学 来源: 题型:
丙烯醇(CH2===CHCH2OH)可发生的化学反应有( )
①加成反应 ②氧化反应 ③燃烧 ④加聚反应 ⑤取代反应
A.只有①②③ B.只有①②③④
C.①②③④⑤ D.只有①③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com