
| A. | 明矾是常用的水处理剂,可以用来淡化海水 | |
| B. | 患有胃溃疡的病人的胃酸过多,可以用小苏打医治 | |
| C. | 生活中常用的铝制品与不锈钢制品不易腐蚀,其原理不同 | |
| D. | 食品包装袋中常有硅胶、生石灰、还原铁粉等,其作用完全相同 |
分析 A、明矾水解生成氢氧化铝胶体,可除去水中的悬浮物;
B.小苏打与胃酸中的盐酸反应生成氯化钠、水和二氧化碳气体,患胃溃疡的病人,为防止胃壁穿孔,不能服用小苏打来治疗;
C.生活中常用的铝制品是因为在空气中形成一层氧化铝薄膜阻止反应进行,不锈钢制品不易腐蚀,是利用改变金属结构加入镍、铬等金属防止腐蚀;
D.硅胶、生石灰是吸收水蒸气,还原铁粉是防止物质氧化;
解答 解:A.明矾水解生成氢氧化铝胶体,可除去水中的悬浮物,但不能使海水淡化,故A错误;
B.小苏打与胃酸中的盐酸反应生成氯化钠、水和二氧化碳气体,反应的化学方程式为:NaHCO3+HCl=NaCl+H2O+CO2↑,患胃溃疡的病人,为防止胃壁穿孔,不能服用小苏打来治疗,因为反应产生的二氧化碳气体会造成胃部气胀,易造成胃穿孔,故B错误;
C.生活中常用的铝制品是因为在空气中形成一层氧化铝薄膜阻止反应进行,不锈钢制品不易腐蚀,是利用改变金属结构加入镍、铬等金属防止腐蚀,原理不同,故C正确;
D.包装食品里常有硅胶、石灰、还原铁粉三类小包,硅胶、石灰是干燥剂;还原铁粉是抗氧化剂,故D错误;
故选C.
点评 本题考查了盐类水解、金属防腐原理、干燥剂的使用等知识,注意知识的积累,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
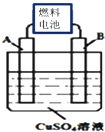 短周期主族元素A,B,C,D,E,F的原子序数依次增大,它们的原子核外电子层数之和为13.B的化合物种类繁多,数目庞大;C,D是空气中含量最多的两种元素,D,E两种元素的单质反应可以生成两种不同的离子化合物;F为同周期半径最小的元素.试回答以下问题:
短周期主族元素A,B,C,D,E,F的原子序数依次增大,它们的原子核外电子层数之和为13.B的化合物种类繁多,数目庞大;C,D是空气中含量最多的两种元素,D,E两种元素的单质反应可以生成两种不同的离子化合物;F为同周期半径最小的元素.试回答以下问题: ,A、C、F三种元素形成的化合物CA4F为离子化合物(填“离子”或“共价”).
,A、C、F三种元素形成的化合物CA4F为离子化合物(填“离子”或“共价”).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 专一性 | B. | 多样性 | C. | 高效性 | D. | 适应性 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
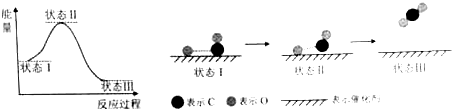
| A. | CO和O生成CO2是吸热反应 | B. | 在该过程中,CO断键形成C和O | ||
| C. | CO和O生成了具有极性共价键的CO2 | D. | 催化剂可改变该反应的焓变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
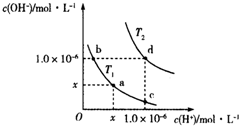
| A. | T2>25℃ | B. | x=1.0×10-7 | ||
| C. | KW(a)=KW(d) | D. | b点溶液呈碱性,c点溶液呈酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在体积为2L的恒容密闭容器中加入0.6mol的CO和H2混合气体,在不同温度下反应CO(g)+2H2O(g)?CH3OH(g)达到平衡,平衡时CH3OH的体积分数随起始n(CO):n(H2)的变化曲线如图所示.则下列结论正确的是( )
在体积为2L的恒容密闭容器中加入0.6mol的CO和H2混合气体,在不同温度下反应CO(g)+2H2O(g)?CH3OH(g)达到平衡,平衡时CH3OH的体积分数随起始n(CO):n(H2)的变化曲线如图所示.则下列结论正确的是( )| A. | 反应CO(g)+2H2O(g)?CH3OH(g)的△H<0 | |
| B. | 图示a点n(CO):n(H2)=0.5,CO转化率最高 | |
| C. | 若在状态Ⅰ和Ⅱ时,再向体系中充入He,重新达到平衡,c(CH3OH,状态Ⅱ)=c(CH3OH,状态Ⅰ) | |
| D. | 正反应速率v正:v正(状态Ⅱ)<v正(状态Ⅲ) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com