
 CO2(g)+H2(g)
CO2(g)+H2(g) 
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������

 ȼ��������̬ˮ���Ȼ�ѧ����ʽ��__________________________��
ȼ��������̬ˮ���Ȼ�ѧ����ʽ��__________________________���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
| �ձ��� | V��ˮ (mL) | Vˮ(mL) | c (NH3��H2O)��mol��L-1�� | c(OH-) | Kb | �� |
| 1 | 50.00 | 0.00 | | 1.34��10-3 | | |
| 2 | 25.00 | 25.00 | | 9.48��10-4 | | |
| 3 | 5.00 | 45.00 | | 4.24��10-4 | | |
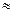 �� ��ͨ���������õ����ݺͼ�������˵�����볣�����������������ʵij�ʼŨ�ȵĹ�ϵ �� ��
�� ��ͨ���������õ����ݺͼ�������˵�����볣�����������������ʵij�ʼŨ�ȵĹ�ϵ �� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
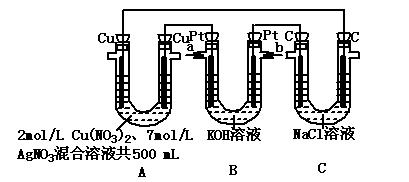
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��

| A��п���ϵ缫��ӦʽΪ��Zn-2e-=Zn2+ |
| B��MnO2�õ��ӱ���ԭ |
| C��NH4+����ͨ����֬��п���ƶ� |
| D������·�е����ķ����̼����пƬ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2Ni(OH)2+Cd(OH)
2Ni(OH)2+Cd(OH) 2����˵������ȷ���ǣ��� ��
2����˵������ȷ���ǣ��� ��| A�����Ϸ�Ӧ�ǿ��淴Ӧ |
| B���ŵ�ʱ����Ϊ���� |
| C�����ʱ����ϱ��С�+���ŵĵ缫���ӵ�Դ���� |
| D�������ӵ��Ϊ��Դ�����Na2CO3��Һ�����ռ�������������Ϊ33��6L������£�ʱ�������ת����2mol���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��Ag | B�� Zn(OH)2 | C�� Ag2O | D��Zn |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com