
【题目】下列反应中生成物总能量高于反应物总能量的是( )
A.形成化学键
B.氢气燃烧
C.铝热反应
D.电解熔融氯化钠
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种物质的相互转化关系如下图所示(反应条件未标出),其中反应①是置换反应。
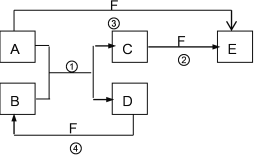
(1)若A、D、F都是非金属单质,且A、D所含元素同主族,A、F所含元素同周期,反应①的化学方程式是______________________。
(2)若A是常见的过渡元素金属单质,D、F是气态单质,反应①在水溶液中进行,则反应②(在水溶液中进行)的离子方程式是____________________;
(3)若B、C、F都是气态单质,且B为黄绿色,有毒,③和④两个反应中都有水生成,反应②需要放电才能发生,A、D相遇有白烟生成,则C的结构式是_________________,反应③的化学方程式是__________________。
(4)若A、D为短周期元素组成的单质,且元素A的原子序数是D的2倍,最外层电子数D是A的2倍,③和④两个反应中都有红棕色气体生成,则反应①的化学方程式是______________________。则反应④的化学方程式是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2016江苏卷】下列图示与对应的叙述不相符合的是( )
A.图甲表示燃料燃烧反应的能量变化
B.图乙表示酶催化反应的反应速率随反应温度的变化
C.图丙表示弱电解质在水中建立电离平衡的过程
D.图丁表示强碱滴定强酸的滴定曲线

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,请回答有关问题:
主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
二 | ① | ② | ||||||
三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
四 | ⑨ | ⑩ |
(1)表中化学性质最不活泼的元素是______。(用元素符号表示)
(2)②③④三种元素的原子半径从大到小的顺序是______(用元素符号表示)
(3)用电子式表示③与⑦形成化合物的过程_______________________。
(4)在①~⑧元素中,元素的最高价氧化物对应的水化物中碱性最强的___。(填化学式)
(5)在⑦与⑩的单质中,化学性质较活泼的是_____。(填化学式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值。下列说法正确的是
A. 2.0gH218O与D2O的混合物中所含中子数为NA
B. 50mL18mol·L-1浓硫酸与足量铜供热,转移电子数为0.9NA
C. 0.1molCl2通入含0.1molFeBr2溶液中,被氧化的溴离子数为0.2NA
D. 标准状况下,2.24LNO和足量O2反应生成物中含有NO2分子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自然界中存在的碘的稳定性核素是碘-127(![]() I)。日本福岛第一核电站事故释放出的放射性物质中,含有人工放射性核素碘-131(
I)。日本福岛第一核电站事故释放出的放射性物质中,含有人工放射性核素碘-131(![]() I)。碘-131(
I)。碘-131(![]() I) 一旦被人体吸入,就可能会引发甲状腺疾病。对于这两种核素的下列说法正确的是
I) 一旦被人体吸入,就可能会引发甲状腺疾病。对于这两种核素的下列说法正确的是
A. ![]() I是一种新元素 B.
I是一种新元素 B. ![]() I的摩尔质量为131g
I的摩尔质量为131g
C. ![]() I和
I和![]() I互为同位素 D.
I互为同位素 D. ![]() I中子数与质子数之差为74
I中子数与质子数之差为74
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:4NH4+ + 6HCHO = 3H++ 6H2O + (CH2)6N4H+ [滴定时,1 mol(CH2)6N4H+与1 mol H+相当],然后用NaOH标准溶液滴定反应生成的酸。某兴趣小组用甲醛法进行了如下实验:
步骤Ⅰ 称取样品1.500 g。
步骤Ⅱ 将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀。
步骤Ⅲ 移取25.00 mL样品溶液于250 mL锥形瓶中,加入10 mL 20%的中性甲醛溶液,摇匀、静置5 min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点。按上述操作方法再重复2次。
(1)根据步骤Ⅲ填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数 (填“偏高”、“偏低”或“无影响”)。
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积 (填“偏大”、“偏小”或“无影响”)。
③滴定时边滴边摇动锥形瓶,眼睛应观察 。
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
④滴定达到终点时,酚酞指示剂由 色变成 色。
(2)滴定结果如下表所示:

若NaOH标准溶液的浓度为0.1010 mol/L,则该样品中氮元素的质量分数为 。(结果保留四位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用A+、B-、C2-、D、E、F、G和H分别表示含有18个电子的八种微粒(离子或分子),请回答:
(1)A元素是________,B元素是___________,C元素是__________(用元素符号表示)。
(2)D是由两种元素组成的双原子分子,其结构式是__________________。
(3)E是所有含18个电子的微粒中氧化能力最强的分子,其分子式是________________。
(4)F是由两种元素组成的三原子分子______,其电子式是________________。
(5)G分子中含有4个原子,它易溶于水的原因是________________
(6)A+与C2-形成的化合物水溶液呈_____性,其原因是(用离子方程式表示)___________,该水溶液中离子浓度由大到小的顺序是_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com