
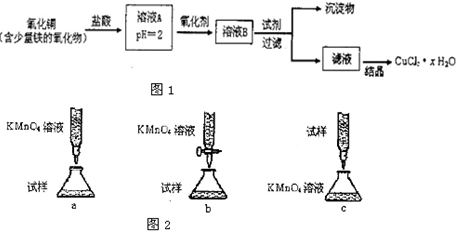
用含少量铁的氧化物的氧化铜制取氯化铜晶体(CuCl2 xH2O)。有如下操作:
xH2O)。有如下操作:
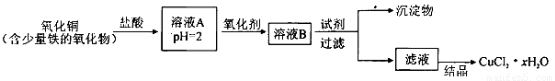
已知:在pH为4~5时,Fe3+几乎完全水解而沉淀,而此时Cu2+却几乎不水解。
(1)溶液A中的金属离子有Fe3+、Fe2+、Cu2+。检验溶液A中Fe2+的最佳试剂为_____(填编号,下同)。
①KMnO4?? ②(NH4)2S??????? ③NaOH???????? ④ KSCN
(2)氧化剂可选用_________。①Cl2? ②KMnO4? ③HNO3? ④H2O2
(3)要得到较纯的产品,试剂可选用_______________。①NaOH ②FeO ③CuO ④Cu2(OH)2CO3
(4)从滤液经过结晶得到氯化铜晶体的方法是_____________(按实验先后顺序选填编号)。
①过滤 ②蒸发浓缩 ③蒸发至干 ④冷却
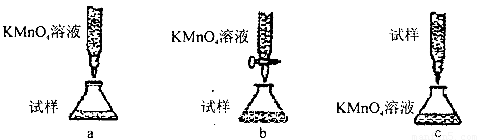
(5)欲测定溶液A中的Fe2+的浓度,实验前,首先要配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻璃棒、烧杯、药匙、胶头滴管外,还需_________,下列滴定方式中,最合理的是___________(夹持部分略去)(填字母序号)。
(6)为了测定制得的氯化铜晶体(CuCl2 xH2O)中的x值,某学生设计了两种实验方案:
xH2O)中的x值,某学生设计了两种实验方案:
方案一:称取mg晶体灼烧至质量不再减轻为止,冷却、称量所得无水CuCl2的质量为n1g
方案二:称取mg晶体溶于水,加入足量氢氧化钠溶液、过滤、沉淀洗涤后用小火加热至质量不再减轻为止,冷却,称量所得固体的质量为n2g。
试评价上述两种实验方案:其中正确的方案是________,理由是___________,据此计算得x=_________(用含m、n1或n2的代数式表示)。
(1)①(2分) (2)①④(2分) (3)③④(2分) (4)②③①(2分)
(5)250ml容量瓶(2分);b(2分) (6)二(2分);晶体灼烧时,结晶水失去时,会形成溶液,促进CuCl2水解(2分);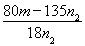 (2分)
(2分)
【解析】
试题分析:(1)亚铁离子具有还原性,能使酸性高锰酸钾溶液褪色,可以用酸性高锰酸钾溶液检验亚铁离子,①正确。(NH4)2S或NaOH与三种金属阳离子均反应不能检验亚铁离子,KSCN溶液只能检验铁离子,因此②③④均不正确,答案选①。
(2)由于在氧化亚铁离子时不能再引入新的杂质,氯气的还原产物是氯离子,双氧水的生成物是水,所以①④正确;氧化剂高锰酸钾会引入Mn2+、K+以及MnO4-,硝酸会引入NO3-,②③不正确,答案选①④。
(3)在调节pH值形成氢氧化铁沉淀时,仍然不能引入新的杂质。氢氧化钠会引入钠离子,氧化亚铁会引入亚铁离子,氧化铜和碱式碳酸铜与酸反应生成铜离子、水、CO2不会引入杂质,因此答案选③④。
(4)氯化铜易溶于水,所以从滤液经过结晶得到氯化铜晶体的方法是蒸发浓缩、冷却结晶然后过滤即可,因此答案选②③①。
(5)要配制一定物质的量浓度的KMnO4溶液250mL,则除了需要天平、玻璃棒、烧杯、药匙、胶头滴管外,还需要250ml容量瓶。酸性高锰酸钾溶液具有强氧化性与酸性,应该放在酸式滴定管中,因此答案选b。
(6)由于氯化铜是强酸弱碱盐,铜离子易水解生成氢氧化铜与氯化氢,水解吸热,且生成的氯化氢具有挥发,所以晶体灼烧时,结晶水失去时,会形成溶液,促进CuCl2水解,因此方案一是错误的,方案二正确。n2g固体是氧化铜,物质的量是 mol,则根据铜原子守恒可知氯化铜晶体的物质的量是
mol,则根据铜原子守恒可知氯化铜晶体的物质的量是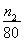 mol,则
mol,则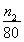 mol×(135+18x)g/mol=mg,解得x=
mol×(135+18x)g/mol=mg,解得x=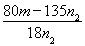 。
。
考点:考查晶体制备、结晶水含量测定、离子检验、物质的分离与提纯、一定物质的量浓度的配制以及滴定实验


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:
| 80m-135n2 |
| 18n2 |
| 80m-135n2 |
| 18n2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源:聊城模拟 题型:问答题
查看答案和解析>>
科目:高中化学 来源:2010年山东省聊城市高考化学模拟试卷(解析版) 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com