
(14分)(1)常温时,将浓度为m mol· L-1的CH3COOH溶液和n mol·L-1NaOH溶液等体积混合,混合后溶液的pH=7,m与n的大小关系是m n(填“>”、“<”或“=”,下同);若将PH=2的CH3COOH溶液和PH=12的NaOH溶液等体积混合,混合溶液的PH 7
(2)消防用的泡沫灭火器内装的药品是硫酸铝溶液和碳酸氢钠溶液,用离子方程式表示二者混合时发生的反应
(3)常温下某强酸溶液pH=a,强碱溶液pH=b,已知a+b=12,酸碱溶液混合pH=7,则酸溶液体积V1和碱溶液体积V2的关系为
(4)常温时KSP[Cu(OH)2]= 2.2×10-20,将Cu(OH)2溶于2.2mol/LCuCl2溶液中形成平衡,溶解平衡方程式为 ,溶液的PH为
(5)物质的量浓度相同的下列溶液①(NH4)2CO3 ②(NH4)2SO4 ③NH4HCO3 ④NH4HSO4 ⑤NH4Cl
⑥NH3·H2O。c(NH4+)由小到大的排列顺序是 (填序号)
⑴m > n;混合溶液的PH<7; ⑵Al3++3HCO3-=Al(OH)3↓+3CO2↑
⑶V2=100V1 或 (V1∶V2=1∶100) ⑷Cu(OH)2(s)  Cu2+(aq)+2OH-(aq), pH = 4 ;
Cu2+(aq)+2OH-(aq), pH = 4 ;
⑸c(NH4+)由小到大的排列顺序是 ⑥<③<⑤<④<①<②
【解析】
试题分析:(1)由于CH3COOH是弱酸,而NaOH是强碱,若二者等体积混合,混合后溶液的pH=7,则必须是酸要过量一些。因此m>n。若将PH=2的CH3COOH溶液,c(H+)=10-2mol/L;由于醋酸是弱酸,所以c(HAc)> 10-2mol/L, PH=12的NaOH溶液,c(OH-)=10-2mol/L;NaOH是强碱,c(NaOH)= c(OH-)=10-2mol/L,若二者等体积混合,由于酸过量所以混合溶液的PH<7。(2)硫酸铝溶液和碳酸氢钠溶液反应的两种方程式是:Al3++3HCO3-=Al(OH)3↓+3CO2↑;(3)常温下某强酸溶液pH=a,c(H+)=10-amol/L;强碱溶液pH=b,c(OH-)=10-14÷10-b=10-(14-b),已知a+b=12,酸碱溶液混合pH=7,V1×10-a = V2·10-(14-b). V1: V2=10-(14-b: 10-a=10-2=1:100。(4) Cu(OH)2难溶于水。但是物质再难溶解,也存在一定的溶解度,在溶液中存在沉淀溶解平衡。Cu(OH)2的沉淀溶解平衡方程式是Cu(OH)2(s)  Cu2+(aq)+2OH-(aq) ;c(Cu2+) =2.2mol/L. KSP[Cu(OH)2]= c(Cu2+)·c2(OH-)= 2.2×10-20,所以c2(OH-)= 2.2×10-20÷2.2=1.0×10-20。因此c(OH-) =1.0×10-10。C(H+)=10-4mol/L。所以pH=4。(5)①(NH4)2CO3和②(NH4)2SO4每个物质能电离产生2个NH4+;而③NH4HCO3、④NH4HSO4、⑤NH4Cl 每种只能电离产生1个NH4+;因此c(NH4+)①和②一定大于③④⑤的。②(NH4)2SO4中只有NH4+离子水解,要消耗;①(NH4)2CO3中铵根离子水解使溶液显酸性,CO32-水解使溶液显碱性,二者相互促进,使NH4+的水解程度比②的小。即c(NH4+):①<②;⑤在NH4Cl中NH4+的水解使溶液显酸性,铵根离子水解消耗;④NH4HSO4电离方程式是:NH4HSO4= NH4++H++ SO42-。电离产生的H+对NH4+的水解起抑制作用,使铵根离子的浓度比⑤大,即⑤<④。③NH4HCO3电离产生的离子都发生水解反应,水解相互促进,所以消耗的铵根离子较多,因此铵根离子的浓度比⑤小。⑥NH3·H2O是弱电解质,电离产生的两种浓度原小于盐电离产生的铵根离子的浓度。因此c(NH4+)由小到大的排列顺序是 ⑥<③<⑤<④<①<②
Cu2+(aq)+2OH-(aq) ;c(Cu2+) =2.2mol/L. KSP[Cu(OH)2]= c(Cu2+)·c2(OH-)= 2.2×10-20,所以c2(OH-)= 2.2×10-20÷2.2=1.0×10-20。因此c(OH-) =1.0×10-10。C(H+)=10-4mol/L。所以pH=4。(5)①(NH4)2CO3和②(NH4)2SO4每个物质能电离产生2个NH4+;而③NH4HCO3、④NH4HSO4、⑤NH4Cl 每种只能电离产生1个NH4+;因此c(NH4+)①和②一定大于③④⑤的。②(NH4)2SO4中只有NH4+离子水解,要消耗;①(NH4)2CO3中铵根离子水解使溶液显酸性,CO32-水解使溶液显碱性,二者相互促进,使NH4+的水解程度比②的小。即c(NH4+):①<②;⑤在NH4Cl中NH4+的水解使溶液显酸性,铵根离子水解消耗;④NH4HSO4电离方程式是:NH4HSO4= NH4++H++ SO42-。电离产生的H+对NH4+的水解起抑制作用,使铵根离子的浓度比⑤大,即⑤<④。③NH4HCO3电离产生的离子都发生水解反应,水解相互促进,所以消耗的铵根离子较多,因此铵根离子的浓度比⑤小。⑥NH3·H2O是弱电解质,电离产生的两种浓度原小于盐电离产生的铵根离子的浓度。因此c(NH4+)由小到大的排列顺序是 ⑥<③<⑤<④<①<②
考点:考查电解质的电离、盐的水解、酸碱混合溶液的pH的计算及离子浓度的大小比较的知识。


科目:高中化学 来源:2013-2014四川省成都市高三第三次诊断性考试理综化学试卷(解析版) 题型:选择题
下图为雾霾的主要成分示意图。下列说法不正确的是
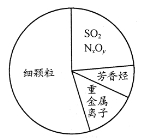
A、重金属离子可导致蛋白质变性
B、苯是最简单的芳香烃
C、SO2、NxOy都属于酸性氧化物
D、利用丁达尔效应可检验雾霾是否为胶体
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省成都市五校高一下学期期中联考化学试卷(解析版) 题型:计算题
(8分)某温度时,在0.5L密闭容器中某一反应的A、B气体物质的量随时间变化的曲线如图所示,由图中数据分析求得:
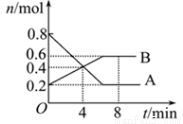
(1)该反应的化学方程式为______________________________。
(2)反应开始至4min时,B的平均反应速率为____________。
(3)平衡时A的转化率为________。第4min时,正逆反应速率的大小关系为:υ(正)___υ(逆)(填“>”、“<”或“=”,下同),第8min时,υ(正)___υ(逆)。
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省成都市五校高一下学期期中联考化学试卷(解析版) 题型:选择题
短周期元素X、Y、Z在元素周期表中的位置如图,关于X、Y、 Z的说法正确的是 ( )
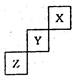
A、相同条件下,三种元素的单质跟氢气反应时,X单质最剧烈
B、由氢、氧和Z元素形成的常见化合物中既含有离子键又含有共价键
C、ZO2能与Z的最高价氧化物对应的水化物反应生成Z单质
D、Y的气态氢化物稳定性比Z的气态氢化物的稳定性强
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省成都市五校高一下学期期中联考化学试卷(解析版) 题型:选择题
最近医学界通过放射性14C来标记C60的羧酸衍生物在特定条件下通过断裂DNA来杀死细胞,从而抑制艾滋病(AIDS),有关14C的叙述正确的是 ( )
A、与C60中普通碳原子的化学性质不同 B、与12C互为同位素
C、与14N含的中子数相同 D、是C60的同素异形体
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省宜昌市春季期中考试高二化学试卷(解析版) 题型:选择题
下列有机物的命名正确的是
A. 1,2─二甲基戊烷 B. 2─乙基戊烷 C. 3,4─二甲基戊烷 D. 3─甲基己烷
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省宜昌市春季期中考试高二化学试卷(解析版) 题型:选择题
近年来,加“碘”食盐较多的使用了碘酸钾(KIO3),碘酸钾在工业上可用电解法制取。以石墨和不锈钢为电极,以KI溶液为电解液,在一定条件下电解,反应方程式为:KI + 3H2O KIO3 + 3H2↑。下列有关说法正确的是
KIO3 + 3H2↑。下列有关说法正确的是
A.电解时,石墨作阴极,不锈钢作阳极
B.电解时,阳极反应是:I –-6e –+ 3H2O = IO3 – + 6H+
C.在KI溶液溶液中加入酚酞,电解时阳极区变红色
D.电解时溶液中I –向阴极迁移
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省高三5月冲刺卷理综化学试卷(解析版) 题型:简答题
(14分)现有5种短周期元素A、B、C、D、E,原子序数依次增大。A的同位素中有一种核素无中子,B最外层上电子数是次外层电子数的两倍,C元素最简单的氢化物Y的水溶液呈碱性,E是短周期中电负性最小的元素。D与可与A、B、C、E四种元素分别形成原子个数比不相同的常见化合物。回答下列问题:
(1)写出A、E两元素形成的原子个数比为1:1的化合物的电子式 。
(2)CS2和B、D元素形成的一种化合物为等电子体,则CS2的分子结构为 ,1molCS2中含有的π键为 个。
(3)Y的中心原子的杂化轨道类型为 ,分子的立体构型为 。
(4)由A、B、D、E形成的化合物W、Z,其中W由三种元素组成,Z由四种元素组成,水溶液物显碱性,用离子方程式表示Z溶液显碱性的原因 。等浓度,等体积的W,Z的混合溶液中,离子浓度由大到小的顺序为 。
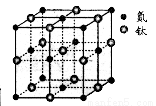
(5)有一种氮化钛晶体的晶胞如图所示,钛原子的电子排布式为 ,该氮化钛的化学式为 ,氮原子的配位数为 。晶胞中N、Ti之间的最近距离为apm,则氮化钛的密度为 g.cm3(NA为阿佛加德罗常数值,只列式计算)。
查看答案和解析>>
科目:高中化学 来源:2013-2014吉林省长春市高一下学期期末考试化学试卷(解析版) 题型:选择题
下图为装有活塞(质量忽略不计)的密闭容器,内盛22.4mL一氧化氮,若通入11.2mL氧气(气体体积均在标准状况下测定),保持温度压强不变,则容器内的密度为(提示:不考虑NO转化为NO2的可逆性)
A. 等于1.369 g·L-1
B. 等于2.054 g·L-1
C. 在1.369g·L-1和2.054g·L-1之间
D. 在2.054g·L-1和4.108g·L-1之间
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com