
分析 (1)从混合物中提取KCl,KCl溶于水,二氧化锰不溶于水,溶解、过滤可分离;
(2)步骤 ②为过滤操作;
(3)过滤中玻璃棒引流,蒸发中玻璃棒搅拌防止局部温度过高;
(4)观察K的焰色反应透过蓝色的钴玻璃,氯离子与硝酸银发生复分解反应生成白色沉淀,且不溶于硝酸.
解答 解:(1)KCl溶于水,二氧化锰不溶于水,从混合物中提取KCl的四个实验步骤:①溶解,②过滤,③蒸发,④冷却结晶,
故答案为:B; C;
(2)步骤 ②为过滤操作,需要的仪器为ABEFG,故答案为:ABEFG;
(3)步骤 ②③中都用到的玻璃仪器是玻璃棒;其在步骤③的作用是搅拌,使液体受热均匀,防止液滴飞溅,
故答案为:玻璃棒;搅拌,使液体受热均匀,防止液滴飞溅;
(4)将制得的少量晶体放入试管,加水溶解,分装在两试管中.其一:用洁净的铂丝蘸取该无色溶液,放在无色火焰上灼烧,透过蓝色钴玻璃观察,火焰颜色为紫色,证明有K+存在;其二先滴加几滴稀硝酸酸化,再加入4~6硝酸银溶液,有白色沉淀生成,证明有Cl-离子存在.写出该反应的化学方程式为KCl+AgNO3═AgCl↓+KNO3,该反应的类型为复分解反应,
故答案为:透过蓝色钴玻璃观察,火焰颜色为紫色;白色沉淀生成;KCl+AgNO3═AgCl↓+KNO3;复分解.
点评 本题考查混合物的分离提纯,为高频考点,把握物质的性质、性质差异、混合物分离方法、离子检验等为解答的关键,侧重分析与实验能力的考查,题目难度不大.


 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | SO2具有漂白性,所以它能使品红溶液、溴水、KMnO4(H+)、石蕊试液褪色 | |
| B. | 能使品红溶液褪色的不一定是SO2 | |
| C. | SO2、漂白粉、活性炭、Na2O2都能使红墨水褪色,其原理相同 | |
| D. | 等物质的量的SO2和Cl2相遇在溶液中具有漂白能力 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
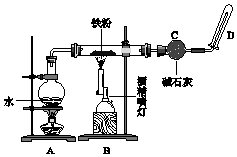 完成实验Fe与水蒸气反应,如图所示.
完成实验Fe与水蒸气反应,如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验编号 | T/℃ | 大理石规格 | HNO3浓度/mol•L-1 |
| ① | 常温 | 细颗粒 | 2.00 |
| ② | 常温 | 细颗粒 | 1.00 |
| ③ | 35℃ | 粗颗粒 | 2.00 |
| ④ | 35℃ | 细颗粒 | 2.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质量数为35的氯原子:${\;}_{35}^{17}$Cl | B. | 16O与18O互为同位素 | ||
| C. | 氯离子的结构示意图: | D. | NaClO的电子式: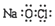 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应中MnO2是氧化剂 | |
| B. | 氧化产物与还原产物物质的量之比为1:3 | |
| C. | KClO3在反应中失去电子 | |
| D. | 反应中每生成l mol K2MnO4,氧化剂得到2 mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀醋酸中加入少量醋酸钠能增大醋酸的电离程度 | |
| B. | 25℃时0.1 mol/L的硫化氢溶液比等浓度的硫化钠溶液的导电能力弱 | |
| C. | NaHCO3溶液中溶质的电离方程式为NaHCO3═Na++H++CO32- | |
| D. | 室温下,对于0.10 mol•L-1的氨水,加水稀释后,溶液中c(NH4+)•c(OH-)变大 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
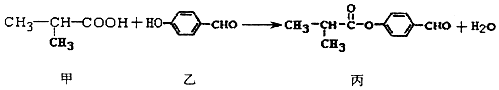
| A. | 丙的分子式为C11H11O3 | |
| B. | 甲分子中含有1个手性碳原子 | |
| C. | 乙、丙各lmol分别和氢气反应,最多消耗氢气均为4mol | |
| D. | 丙可发生加成反应、取代反应、氧化反应等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验装置 | 实验现象 |
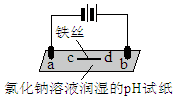 | a处试纸变蓝; b处变红,局部褪色; c处试纸变蓝; d处无明显变化 |
| A. | a为电解池的阴极 | |
| B. | b处有氯气生成,且与水反应生成了盐酸和次氯酸 | |
| C. | d处发生了反应:Fe-3e-=Fe3+ | |
| D. | c处:2H2O+2e-=H2↑+2OH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com