
 ; NH3的VSEPR模型为正四面体;请解释加入乙醇后析出晶体的原因乙醇分子的极性比水弱,由于减小溶剂的极性,降低离子化合物Cu(NH3)4SO4•H2O的溶解度.
; NH3的VSEPR模型为正四面体;请解释加入乙醇后析出晶体的原因乙醇分子的极性比水弱,由于减小溶剂的极性,降低离子化合物Cu(NH3)4SO4•H2O的溶解度. .乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高得多,原因是乙二胺分子间存在氢键而三甲胺没有,由于氢键的作用力比范德华力大,故乙二胺沸点比三甲胺高.
.乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高得多,原因是乙二胺分子间存在氢键而三甲胺没有,由于氢键的作用力比范德华力大,故乙二胺沸点比三甲胺高.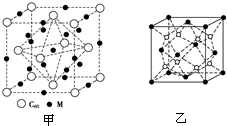
分析 (1)Cu是29号元素,原子核外电子数为29,Cu2+的价层电子数是9个,所以Cu2+的价电子为3d9;根据价电子对互斥理论确定NH3的VSEPR模型;根据相似相容原理,极性分子易溶于极性溶剂,乙醇分子极性比水分子极性弱,加入乙醇降低溶剂的极性,从而减小溶质的溶解度;
(3)配位键由提供孤电子对的原子指向提供空轨道的原子,该配位原子为N原子,中心原子铜周围与4个氮原子相连;氢键影响物质的溶沸点,乙二胺(H2N-CH2-CH2-NH2)分子之间可以形成氢键,但三甲胺[N(CH3)3]分子之间不能形成氢键;
(4)①根据两种物质的杂化类型分析共价键类型;
②M原子位于晶胞的棱上与内部,C60分子位于顶点和面心,利用均摊法确定M原子和C60分子的个数比,从而确定化学式;
③根据晶胞(Na2O)结构可知,顶点和面心处是阴离子,阳离子全部在晶胞内,所以与钠离子最近的阴离子是4个,即配位数是4.而距一个阴离子周围最近的所有阳离子为顶点构成的几何体是正方体.该晶胞中含有4个阴离子;
④甲、乙都能和丙形成原子个数比为1:3的常见微粒分别是CO32-、NO3-,原子数总数相同、价电子总数相同的微粒,互称为等电子体.
解答 解:(1)Cu是29号元素,原子核外电子数为29,基态原子核外电子排布式为:1s22s22p63s23p63d104s1,Cu2+的价层电子数是9个,所以Cu2+的价电子排布图为 ,氨气分子中价层电子对个数=σ键个数+孤电子对个数=3+$\frac{1}{2}$(5-3×1)=4,VSEPR模型为正四面体结构;根据相似相容原理,极性分子易溶于极性溶剂,乙醇分子极性比水分子极性弱,由于减小溶剂的极性,降低离子化合物Cu(NH3)4SO4•H2O的溶解度,
,氨气分子中价层电子对个数=σ键个数+孤电子对个数=3+$\frac{1}{2}$(5-3×1)=4,VSEPR模型为正四面体结构;根据相似相容原理,极性分子易溶于极性溶剂,乙醇分子极性比水分子极性弱,由于减小溶剂的极性,降低离子化合物Cu(NH3)4SO4•H2O的溶解度,
故答案为:
故答案为: ; 正四面体;乙醇分子的极性比水弱,由于减小溶剂的极性,降低离子化合物Cu(NH3)4SO4•H2O的溶解度;
; 正四面体;乙醇分子的极性比水弱,由于减小溶剂的极性,降低离子化合物Cu(NH3)4SO4•H2O的溶解度;
(3)配位键由含有孤电子对的原子指向含有空轨道的原子,中心原子铜原子具有空轨道,N原子含有孤电子对,所以该配合物中的配位键为: ,分子之间可以形成氢键使物质的溶沸点升高,乙二胺(H2N-CH2-CH2-NH2)分子之间可以形成氢键,三甲胺[N(CH3)3]分子之间不能形成氢键,由于氢键的作用力比范德华力大,故乙二胺的沸点较高,
,分子之间可以形成氢键使物质的溶沸点升高,乙二胺(H2N-CH2-CH2-NH2)分子之间可以形成氢键,三甲胺[N(CH3)3]分子之间不能形成氢键,由于氢键的作用力比范德华力大,故乙二胺的沸点较高,
故答案为: ;乙二胺分子间存在氢键而三甲胺没有,由于氢键的作用力比范德华力大,故乙二胺沸点比三甲胺高;
;乙二胺分子间存在氢键而三甲胺没有,由于氢键的作用力比范德华力大,故乙二胺沸点比三甲胺高;
(4)①金刚石中碳原子以sp3杂化,形成四条杂化轨道,全部形成σ键;石墨中碳原子以sp2杂化,形成三条杂化轨道,还有一条为杂化的p轨道,三条杂化轨道形成σ键,而未杂化p轨道形成π键,所以石墨的C-C键的键长短,
故答案为:是金刚石中C-C间只存在σ共价键,而石墨层内的C-C间不仅存在σ共价键,还有大π键;
②M原子位于晶胞的棱上与内部,棱上有12个M,内部有9个M,其个数为12×$\frac{1}{4}$+9=12,C60分子位于顶点和面心,C60分子的个数为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,M原子和C60分子的个数比为3:1,则该材料的化学式为M3C60,
故答案为:M3C60;
③根据晶胞(Na2O)结构可知N(Na+):N(O2-)=2:1,所以顶点和面心处是阴离子,阳离子全部在晶胞内,所以与钠离子最近的阴离子是4个,即配位数是4.而距一个阴离子周围最近的所有阳离子为顶点构成的几何体是正方体(立方体);该晶胞中含有4个阴离子,所以有有$\frac{{a}^{3}×ρ×{N}_{A}}{62}$=4,解得a=$\root{3}{\frac{248}{ρ{N}_{A}}}$.
故答案为:正方体(立方体);$\root{3}{\frac{248}{ρ{N}_{A}}}$;
④甲、乙都能和丙形成原子个数比为1:3的常见微粒分别是CO32-、NO3-,SO3或BF3或BCl3的原子数都为4,价电子数都为24,属于等电子体,
故答案为:SO3或BF3或BCl3.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、配位键、杂化轨道、晶胞结构与计算、等电子体等知识,晶胞结构对学生的空间想象有一定的要求,注意利用均摊法进行计算,题目难度中等.


科目:高中化学 来源: 题型:选择题
| 选项 | X(括号中的物质为杂质) | ① | ② |
| A | 乙酸乙酯(乙醇) | 饱和碳酸钠溶液 | 萃取、分液 |
| B | BaSO4(BaSO3) | 稀硝酸 | 过滤 |
| C | NaCl(Na2CO3) | 盐酸 | 蒸发结晶 |
| D | 铜(铝) | 浓硫酸 | 过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向次氯酸钠溶液中通入足量SO2气体:ClO-+SO2+H2O═HClO+HSO3- | |
| B. | 0.1mol/LNH4Al(SO4)2溶液与0.2mol/LBa(OH)2溶液等体积混合:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O | |
| C. | 用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O | |
| D. | Fe2O3溶于过量氢碘酸溶液中:Fe2O3+6H++2I-═2Fe2++I2+3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 $\stackrel{还原}{→}$
$\stackrel{还原}{→}$ )
) (甲苯)$→_{浓H_{2}SO_{4}}^{浓HNO_{3}}$甲$\stackrel{氧化}{→}$乙$→_{③}^{E}$
(甲苯)$→_{浓H_{2}SO_{4}}^{浓HNO_{3}}$甲$\stackrel{氧化}{→}$乙$→_{③}^{E}$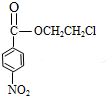 $\stackrel{还原}{→}$丙$→_{④}^{F}$
$\stackrel{还原}{→}$丙$→_{④}^{F}$ (普鲁卡因)
(普鲁卡因)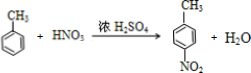 .反应③的化学方程式是(乙中有两种含氧官能团):
.反应③的化学方程式是(乙中有两种含氧官能团):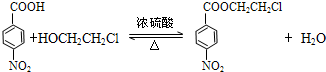 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  图中滴加乙醇,试管中橙色溶液变为绿色,说明K2Cr2O4被还原成K2CrO4 | |
| B. |  图中,右边试管中产生气泡迅速,说明氯化铁的催化效果比二氧化锰好 | |
| C. |  图中,由试管中收集到的无色气体,证明铜与稀硝酸的反应产物是NO | |
| D. |  图中,试管中先出现白色沉淀、加Na2S后产生黑色沉淀,但不能验证AgCl的溶解度大于Ag2S |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
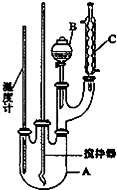 实验室制备硝基苯的反应原理和实验装置如下:
实验室制备硝基苯的反应原理和实验装置如下: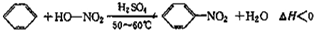
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 溶解性 |
| 苯 | 5.5 | 80 | 0.88 | 微溶于水 |
| 硝基苯 | 5.7 | 210.9 | 1.205 | 难溶于水 |
| 间二硝基苯 | 89 | 301 | 1.57 | 微溶于水 |
| 浓硝酸 | 83 | 1.4 | 易溶于水 | |
| 浓硫酸 | 338 | 1.84 | 易溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
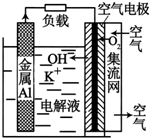 铝-空气电池以高纯度铝(含铝99.99%)为负极,氧气为正极,以KOH溶液为电解质溶液.如图为某铝-空气电池工作的原理示意图,下列有关说法正确的是( )
铝-空气电池以高纯度铝(含铝99.99%)为负极,氧气为正极,以KOH溶液为电解质溶液.如图为某铝-空气电池工作的原理示意图,下列有关说法正确的是( )| A. | 铝-空气电池要及时回收处理,以免造成重金属污染 | |
| B. | 每消耗1molAl,电解质溶液中会有3 mol电子通过 | |
| C. | 负极上的电极反应式为:Al-3e-+4OH-═AlO2-+2H2O | |
| D. | 电池总反应式为:Al+KOH+O2═KAlO2+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
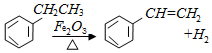 ,下列说法正确的是( )
,下列说法正确的是( )| A. | 该反应的类型为消去反应 | |
| B. | 乙苯的同分异构体共有三种 | |
| C. | 可用Br2、CCl4鉴别乙苯和苯乙烯 | |
| D. | 乙苯和苯乙烯分子内共平面的碳原子数均为7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| R | T | |
| X | Y | Z |
| A. | 气态氢化物稳定性:Y>T | |
| B. | R能分别与X、Z形成共价化合物 | |
| C. | R位于元素周期表中第二周期第VA族 | |
| D. | Z元素的最高价氧化物对应的水化物的化学式为HZO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com