
【题目】如图是某物质甲的溶解度曲线.求: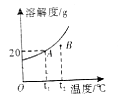
①t1℃,甲的饱和溶液中溶质的质量分数(精确到0.1%);
②t2℃,B点对应的溶液是否饱和?
【答案】解:①t1℃时甲的溶解度是20g,即100g水中最多溶解20g的甲,饱和溶液中溶质的质量分数 ![]() ×100%≈16.7%; ②t2℃,B点在溶解度曲线的下方,对应溶液是不饱和溶液;
×100%≈16.7%; ②t2℃,B点在溶解度曲线的下方,对应溶液是不饱和溶液;
故答案为:①t1℃,甲的饱和溶液中溶质的质量分数是16.7%;②t2℃,B点对应的溶液是不饱和溶液.
【解析】①据饱和溶液中溶质的质量分数= ![]() ×100%解答;②溶解度曲线下方的点表示该溶液是不饱和溶液.明确饱和溶液中溶质的质量分数的计算方法、及溶解度曲线下方的点表示溶液处于不饱和状态,溶解度曲线上的点及上方的点表示溶液处于饱和状态即可顺利解答.
×100%解答;②溶解度曲线下方的点表示该溶液是不饱和溶液.明确饱和溶液中溶质的质量分数的计算方法、及溶解度曲线下方的点表示溶液处于不饱和状态,溶解度曲线上的点及上方的点表示溶液处于饱和状态即可顺利解答.
【考点精析】掌握固体溶解度曲线及其作用和溶质的质量分数、溶解性和溶解度的关系是解答本题的根本,需要知道1.查找指定温度时物质的溶解度,并根据溶解度判断溶解性.2.比较相同温度时(或一定温度范围内)不同物质溶解度的大小.3.比较和确定物质的溶解度受温度影响的程度,并据此确定物质结晶或混合物分离提纯的方法.4.确定溶液的状态(饱和与不饱和);溶质质量分数 =溶质质量/溶液质量*100% ;溶解度=溶质质量/溶剂质量*100g (必须选取饱和溶液);溶液质量=溶质质量(克)+溶剂质量(克) ;对于饱和溶液,溶液质量分数w = S/(S+100);所以溶解度S = 100/(1/w-1).


科目:高中化学 来源: 题型:
【题目】在2L密闭容器中通入a molX气体并发生反应:2X(g) ![]() Y(g),在T1、T2温度下,X的物质的量n(X)随时间t变化的曲线如图所示。下列叙述不正确的是
Y(g),在T1、T2温度下,X的物质的量n(X)随时间t变化的曲线如图所示。下列叙述不正确的是

A. 正反应方向为放热反应
B. 在T2温度下,在0~t1时间内,v (Y) = ![]() mol(Lmin)-1
mol(Lmin)-1
C. M点的正反应速率v(正)大于N点的逆反应速率v(逆)
D. W点时再加入一定量X,平衡后X的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚铁氰化钾K4[Fe(CN)6],俗名黄血盐,可溶于水,不溶于乙醇。在化学实验、电镀、食品添加剂、烧制青花瓷时可用于绘画等方面有广泛用途。已知HCN是一种极弱的酸,现有一种用含NaCN的废水合成黄血盐的主要工艺流程如下:
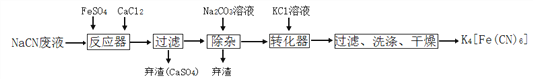
(1)常温下,NaCN水溶液的pH _______ 7(填“>”、“=”、“<”),实验室用NaCN固体配制NaCN溶液时,应先将其溶于_______溶液,再用蒸馏水稀释。
(2)反应器中发生的主要反应的化学方程式为 _____________________________。
(3)流程中加入Na2CO3溶液后过滤除去弃渣,过滤需要的玻璃仪器有烧杯、漏斗、______。
(4)转化器中生成K4[Fe(CN)6]的反应类型是________________,相同温度下,溶解度:K4[Fe(CN)6] _______ Na4[Fe(CN)6](填“>”、“=”、“<”) ,过滤后洗涤K4[Fe(CN)6]使用的试剂是________________。
(5)实验室常用K4[Fe(CN)6]检验Fe3+,生成难溶盐KFe[Fe(CN)6],试写出上述反应的离子方程式为 _________________________。
(6)含有14.7kg NaCN的工业废水可生产出9.2kg的K4[Fe(CN)6],则K4[Fe(CN)6]的产率是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为2L的密闭容器中充入3mol气体A和2.5mol气体B,发生反应:3A(g)+B(g)![]() xC(g)+2D(g).5min以后,测得生成1mol D,C的平均反应速率v(C)=0.1mol/(L·min).试求:
xC(g)+2D(g).5min以后,测得生成1mol D,C的平均反应速率v(C)=0.1mol/(L·min).试求:
(1)方程式中C的化学计量数x=________。
(2)5min内A的平均反应速率v(A)=________。
(3)5min时B的转化率为________。
(4)温度升高A的转化率________(填“增大”、“减小”或“不变”);压强增大B的转化率________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、W为六种前四周期元素,它们的原子序数依次增大。A与D同主族,可形成DA型离子化合物,B与C同周期且相邻,C与E同主族,E2-与Ar原子具有相同的电子层结构,W的合金用量最大、用途最广。请回答下列问题:
(1)D在元素周期表中的位置________________。
(2)A分别与C、E形成最简单化合物中沸点较高的是______________(填化学式),原因是__________。
(3)A、C、D三种元素形成的物质中含有的化学键类型________________,灼热的碳能与B的最高价氧化物对应水化物的浓溶液反应,化学反应方程式为____________________。
(4)向盛有A2C2溶液的试管中加入几滴酸化的WEC4溶液,溶液变成棕黄色,发生反应的离子方程式为___________________________;一段时间后,溶液中有气泡出现,并放热,随后有红褐色沉淀生成,产生气泡的原因是_____________;生成沉淀的原因是__________________________(用平衡移动原理解释)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如图中a、b、c三种物质的溶解度曲线,回答下列问题:
(1)P点表示在t1℃两物质的溶解度关系为bc(填“>”、“<”或“=”).
(2)t2℃,a、b、c三种物质的饱和溶液溶质质量分数的大小关系为 .
(3)t2℃时,50g b物质加入到50g水中充分溶解后,所得溶液的质量为 .
(4)b中含有少量的a,若要提纯b,可采用结晶的方法.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH3、N2H4在工业生产和国防建设中都有广泛应用。回答下列问题:
(1)①N2H4(g) ![]() N2(g)+2H2(g) △H1
N2(g)+2H2(g) △H1
②N2(g)+3H2(g) ![]() 2NH3(g) △H2
2NH3(g) △H2
③7N2H4(g) ![]() 8NH3(g)+3N2(g)+2H2(g) △H3
8NH3(g)+3N2(g)+2H2(g) △H3
△H3=___________(用含△H1和△H2的代数式表示),反应③的平衡行数表达式为K=___________。
(2)纳米钴的催化作用下,N2H4可分解生成两种气体,其中一种能使湿润的红色石蕊试纸变蓝。当反应在不同温度下达到平衡时,混合气体中各组分的体积分数如图所示。

该反应的△H_____________(填“>”或“<”)0,N2H4发生分解反应的化学方程式为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com