
ijǿ������ҺX�н�����Ba2+��Al3+��NH4+��Fe2+��Fe3+��CO32����SO32����SO42����Cl����NO3���е�һ�ֻ��֣�ȡ����Һ��������ʵ�飬ʵ��������£�
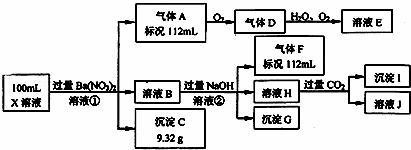
����������Ϣ���ش��������⣺
��1����������������ʵ�鲻��ȷ����ҺX���Ƿ��е����������ӷֱ�����
�����ӷ��̱������з�Ӧ��
������������A��������
����������ҺH��������
��3��������������������Ũ��Ϊ2mol/L��������l0mlʱ��ʼ����������55mlʱ���������ﵽ���ֵ0.03mol�������μӳ����������ֲ��䣬����ٵμӳ��������ܽ⣬��60mlʱ����������Ϊ0.025mol�ұ��ֲ��䣬��ԭ��Һ��c��Fe2+��Ϊ����mol/L��c��Fe3+��Ϊ����mol/L��c��Cl����Ϊ����mol/L��������Щ���Ӳ����ڣ�����0mol/L��
���㣺 �������ӵļ��鷽����
������ ��ǿ������Һ��һ���������CO32����SO32�����ӣ�����������ᱵ���ɳ�������ó���CΪBaSO4��˵����Һ�к���SO42�����ӣ��������ᱵ���������Լ�����������ӵ����ʵ�������������A��A������������D��E����AΪNO��DΪNO2��EΪHNO3��˵����Һ�к��л�ԭ�����ӣ���һ��ΪFe2+���ӣ�����NO��������Լ����������ӵ�������ҺB�м������NaOH��Һ������GֻΪFe��OH��3����������F����FΪNH3��˵����Һ�к���NH4+���ӣ���ҺH��ͨ��CO2���壬���ɳ���I����IΪAl��OH��3��HΪNaOH��NaAlO2��˵����Һ�к���Al3+���ӣ��ٸ������ӹ���֪ʶ����Һ�к���Fe2+���ӣ���һ������NO3�����ӣ�����SO42�����Ӿ�һ������Ba2+���ӣ�����ȷ���Ƿ��е�����Fe3+��Cl�����Դ˽��н��
��� �⣺ǿ������Һ��һ���������CO32����SO32�����ӣ�����������ᱵ���ɳ�������ó���C9.32gΪBaSO4��˵����Һ�к���SO42�����ӣ��������ᱵ���������Լ�����������ӵ����ʵ���Ϊ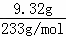 =0.04mol��Ũ����
=0.04mol��Ũ���� =0.4mol/L����������A��A������������D��E����AΪNO��DΪNO2��EΪHNO3��˵����Һ�к��л�ԭ�����ӣ���һ��ΪFe2+���ӣ�����NO��������Լ����������ӵ�������ҺB�м������NaOH��Һ������GֻΪFe��OH��3����������F����FΪNH3��˵����Һ�к���NH4+�������ʵ�����0.005mol��Ũ����0.05mol/L��
=0.4mol/L����������A��A������������D��E����AΪNO��DΪNO2��EΪHNO3��˵����Һ�к��л�ԭ�����ӣ���һ��ΪFe2+���ӣ�����NO��������Լ����������ӵ�������ҺB�м������NaOH��Һ������GֻΪFe��OH��3����������F����FΪNH3��˵����Һ�к���NH4+�������ʵ�����0.005mol��Ũ����0.05mol/L��
����ҺH��ͨ��CO2���壬���ɳ���I����IΪAl��OH��3��HΪNaOH��NaAlO2��˵����Һ�к���Al3+���ӣ��ٸ������ӹ���֪ʶ����Һ�к���Fe2+���ӣ���һ������NO3�����ӣ�����SO42�����Ӿ�һ������Ba2+���ӣ�����ȷ���Ƿ��е�����Fe3+��Cl����
��1���������Ϸ�����֪����Һ�в���ȷ����������ΪFe3+����Һ�в���ȷ����������ΪCl�����ʴ�Ϊ��Fe3+��Cl����
���еõ�������A��NO��Fe2+���ӱ�����ΪFe3+���ӣ�NO3�����ӱ���ԭΪNO���壬��Ӧ�����ӷ���ʽΪ��3Fe2++NO3��+4H+=3Fe3++NO��+2H2O��
��H��ƫ��������Һ��������������������Ƶķ�Ӧ������ƫ��������Ӻ�ˮ�����ӷ���ʽ��Al3++4OH��=AlO2��+2H2O���ʴ�Ϊ��Al3++4OH��=AlO2��+2H2O��
��3�����ݷ�Ӧ��3Fe2++NO3��+4H+=3Fe3++NO��+2H2O���õ�112mL0.005molNO��Fe2+�����ʵ�����0.015mol������ԭ��Һ��c��Fe2+��=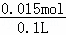 =0.15mol/L����������������60mlʱ������������Ϊ0.025mol�����������������ʵ�����0.025mol��������Ԫ���غ㣬����Fe3+�����ʵ�����0.01mol������ԭ��Һ��c��Fe3+��=
=0.15mol/L����������������60mlʱ������������Ϊ0.025mol�����������������ʵ�����0.025mol��������Ԫ���غ㣬����Fe3+�����ʵ�����0.01mol������ԭ��Һ��c��Fe3+��=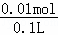 =0.1mol/L����������ӵ����ʵ���Ϊ
=0.1mol/L����������ӵ����ʵ���Ϊ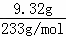 =0.04mol��Ũ����
=0.04mol��Ũ���� =0.4mol/L��NH4+�������ʵ�����0.005mol��Ũ����0.05mol/L��Al3+�����ʵ�����0.005mol��Ũ����0.05mol/L��
=0.4mol/L��NH4+�������ʵ�����0.005mol��Ũ����0.05mol/L��Al3+�����ʵ�����0.005mol��Ũ����0.05mol/L��
2c��Fe2+��+3c��Fe3+��+3c��Al3+��+c��NH4+��=mol/L=0.8mol/L��2c��SO42����=0.8mol/L������c��Cl����Ϊ0��
�ʴ�Ϊ��0.15�� 0.1��0��
������ ���⿼���˳����������ӵļ��顢���ƶϣ���Ŀ�Ѷ��еȣ�ע�����ճ������ӵ����ʼ����鷽������3��Ϊ�ѵ㡢�״��㣬ע����Һ������֪ʶ�ڻ�ѧ�����е�Ӧ�÷����������ֿ�����ѧ���ķ������������������Ӧ����ѧ֪ʶ��������
��


 ��ѧ�̸̳����¿α�ϵ�д�
��ѧ�̸̳����¿α�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�л���A�ķ���ʽΪC11H16�����ⶨ���ݱ����������г��������ⲻ�ٺ���������״�ṹ���ұ�����ֻ��һ�����������ϴ����������Ľṹ�У�������
| �� | A�� | 5�� | B�� | 6�� | C�� | 7�� | D�� | 8�� |
��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��֪��������������Ĵ������¿�ת��Ϊ���ᣨC3H6O3����
��1��ȡ9.0g���������������Ʒ�Ӧ���ɲ���2.24L���壨��״��������ȡ9.0g��������ͬ���ʵ������Ҵ���Ӧ������0.1mol����������1.8g H2O���ɴ��ƶ���������к��еĹ����ŵ����Ƽ���Ŀ��������
��2��������ͭ������ʱ���������ɱ�ͪ�ᣨCH3COCOOH�������������һ�������¿ɷ������۷�Ӧ����һ�ָ߷��ӻ�����˸߷��ӻ�����Ľṹ��ʽΪ������
��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����������ʵ��ó��Ľ�����ȷ���ǣ�������
��� ʵ�� ����
A ��ij��Һ�м���ϡ���ᣬ������������ͨ�����ʯ��ˮ��ʯ��ˮ����� ����Һһ����̼������Һ
B �ò�˿պȡ����ij��Һ�ھƾ��ƻ����Ͻ�����ɫ��Ӧ������ʻ�ɫ ����Һ��һ����������Һ
C ��������Һ�м�ϡ���ᣬ����Ƭ�̣��μ�������Һ��ˮԡ���ȣ����������� �õ���δ����ˮ��
D ��ij��Һ�еμ�KSCN ��Һ����Һ����ɫ���μ���ˮ����Һ�Ժ�ɫ ����Һ��һ����Fe2+
�� A�� A B�� B C�� C D�� D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ij��Һ���ܺ���Cl����SO42����CO32����NH4+��Fe3+��Al3+��K+�е����ֻ���֣�ȡ����Һ100mL���������NaOH��Һ�����ȣ��õ�448mL����������壬ͬʱ�������ɫ�����������ˡ�ϴ�ӡ����գ��õ�1.6g���壻��������Һƽ���ֳ����ݣ�һ���м�����BaCl2��Һ���õ�2.33g����������ij�������һ����ͨ�����CO2�õ�1.56g��ɫ�������ɴ˿��ƶ�ԭ��Һһ�����е��������༰��Ũ�ȣ�����������±����ɲ���������
һ�����е��������� ���� ���� ����
���ʵ���Ũ�ȣ�mol/L�� ���� ���� �� ���� ���ݡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
4mA��g��+nB��g��⇌pC��g��+qQ��g����m��n��p��qΪ��������ʱ���ﵽƽ��ı�־�ǣ���
����ϵ��ѹǿ���ٸı�
����ϵ���¶Ȳ��ٸı�
�۸���ֵ�Ũ�Ȳ��ٸı�
�ܸ���ֵ������������ٸı�
�ݷ�Ӧ����VA��VB��VC��VD=m��n��p��q
��λʱ����m mol A�ϼ���Ӧ��ͬʱp mol CҲ�ϼ���Ӧ��
A�� �ۢܢݢ� B�� �ڢۢܢ� C�� �٢ۢܢ� D�� �٢ۢܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���в�ͬ�����µĻ�ѧ��Ӧ��A��aq��+B��aq��═C��aq��+D��aq����Ӧ�����ɴ�С��˳����ȷ���ǣ���
�ٳ�����20mL��Һ��A��B��0.001mol
�ڳ�����100mL��Һ��A��B��0.01mol
�۳�����0.05mol/L A��B��Һ��10mL��Ϻ��ټ�ˮ20mL
�ܳ����½�100mL��A 0.001mol��20mL��B 0.001mol�����Һ��ϣ�
A�� �٢ڢۢ� B�� �ڢۢܢ� C�� �ڢ٢ۢ� D�� �ڢܢ٢�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��֪��ŨH2SO4���ڲ�������170��Ĺ����У�2�����������ǻ��Ͽɷ������Ӽ���ˮ��Ӧ�����ѣ���
CH3CH2��OH��HO��CH2CH3 CH3CH2��O��CH2CH3��H2O
CH3CH2��O��CH2CH3��H2O
��ŨH2SO4������ʽ�ֱ�ΪC2H6O��C3H8O�Ĵ��Ļ��Һ��Ӧ���ɵõ����л����������(����)
A��2�� B��4�� C��6�� D��8��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�������ᡢ�Ȼ��ơ��������ƺ���ˮ������Һ���������������ǵ�һ���Լ���( )
A��AgNO3 B����̪�Լ� C����ɫʯ����Һ D������ʳ��ˮ
��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com