
A、B、X、Y和Z是原子序数依次递增的短周期元素,其中A与Y同主族,X与Z同主族,A与B和A与X均可形成10个电子化合物;B与Z的最外层电子数之比为2︰3,常见化合物Y2X2与水反应生成X的单质,其溶液可使酚酞试液变红。请回答下列问题。
(1) X在周期表中的位置是__________________________
(2) 化合物Y2X2的电子式为 ;它含有的化学键类型有 (填序号)。
A.离子键 B.极性共价键 C.非极性共价键 D.氢键
(3) A与X和A与Z均能形成18个电子的化合物,此两种化合物发生反应生成Z的化学方程式为_____________________________________。
(4) A的单质与X的单质可制成新型的化学电源(KOH溶液作电解质溶液),两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电,则正、负极电极反应式为_________________________,________________________。
(5) 写出化合物Y2X2与水反应的离子方程式_____________________。
(6) B的最高价氧化物的结构式为_______________________________。
(16分)(1)第二周期ⅥA族 (2)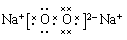 A、C(全对给分)
A、C(全对给分)
(3)H2O2+H2S=S↓+2H2O (4) 负极反应式:2H2 – 4e – + 4OH-=4H2O
正极反应式:O2 +4e –+ 2H2O-=4 OH–
(5)2Na2O2+2H2O=4 Na++4OH-+O2↑ (6) O=C=O
【解析】
试题分析:常见的10电子化合物有CH4、NH3、H2O、HF等,多为氢化物,A与B和A与X均可形成10个电子化合物,则A为H元素,常见化合物Y2X2与水反应生成X的单质,其溶液可使酚酞试液变红,则该化合物为Na2O2,其中Y为Na元素,X为O元素,X与Z同主族,则Z为S元素,最外层电子数为6,B与Z的最外层电子数之比为2:3,则B的最外层电子数为4,根据A、B、X、Y和Z是原子序数依次递增可知B为C元素。
(1) X是O元素,故在周期表中的位置是第二周期ⅥA族。
(2)化合物Y2X2为Na2O2,为离子化合物,含有离子键和非极性共价键,电子式为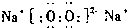 。
。
故答案为: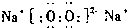 ;A、C。
;A、C。
(3) A与X和A与Z形成的18电子化合物分别为H2O2、H2S,其中H2O2具有氧化性,H2S具有还原性,二者发生氧化还原反应生成S和H2O,反应的化学方程式为H2O2+H2S=S↓+2H2O。
故答案为:H2O2+H2S=S↓+2H2O。
(4)碱性氢氧燃料电池中,通入氢气的一极为电源的负极,通入氧气的一极为电源的正极,其中正极发生还原反应,电极反应式为:O2 +4e –+ 2H2O-=4 OH–;负极发生氧化反应,电极反应式为H2-2e-+2OH-═2H2O,
故答案为:负极反应式:2H2 – 4e – + 4OH-=4H2O
正极反应式:O2 +4e –+ 2H2O-=4 OH–。
(5) Y2X2是Na2O2,与水反应的离子方程式为2Na2O2+2H2O=4 Na++4OH-+O2↑。
(6) B是C元素,B的最高价氧化物是CO2,故B的最高价氧化物的结构式为O=C=O。
考点:位置结构性质的相互关系应用 化学电源新型电池
点评:本题考查元素位置结构性质的关系及应用,题目难度中等,本题侧重于物质的结构和性质的考查,学习中注重相关基础知识的积累。


科目:高中化学 来源: 题型:




查看答案和解析>>
科目:高中化学 来源: 题型:




查看答案和解析>>
科目:高中化学 来源: 题型:




查看答案和解析>>
科目:高中化学 来源:2013届四川省高一下学期期中考试化学试卷 题型:填空题
(12分)A、B、X、Y和Z是原子序数依次递增的短周期元素,其中A与Y同主族,X与Z同主族,A与B和X均可形成10个电子化合物;B与Z的最外层电子数之比为2∶3,常见化合物Y2X2与水反应生成X的单质,其溶液可使酚酞试液变红.请回答下列问题.
(1)Z的离子结构示意图为 ;化合物BA4的电子式为 。
(2)化合物Y2X2中含有的化学键类型有________ (填序号).
A.离子键 B.极性共价键 C.非极性共价键 D.氢键
(3)化合物A2X和A2Z中,沸点较高的是_______ (填化学式),其主要原因_______ _______ _______ 。
(4)A与X和A与Z均能形成18个电子的化合物,此两种化合物发生反应生成A2X和Z单质,试写出化学方程式____________________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com