
| A. | 1:2 | B. | 2:1 | C. | 1:1 | D. | 4:1 |
分析 设NO和NO2的物质的量分别为xmol、ymol,根据二者总体积、电子转移守恒列方程,再根据在相同状态下,气体的体积之比等于物质的量之比来求算.
解答 解:32g铜的物质的量为$\frac{32g}{64g/mol}$=0.5mol,在反应中失去的电子的物质的量为2×0.51mol=1.02mol,11.2L混合气体的物质的量为$\frac{11.2L}{22.4L/mol}$=0.5mol
令NO和NO2的物质的量分别为xmol、ymol,则:
x+y=0.5mol ①
3x+y=0.5mol×2 ②
解得x=0.25,y=0.25,
在相同状态下,气体的体积之比等于物质的量之比,故生成的NO和NO2的体积之比为0.25:0.25=1:1,故选C.
点评 本题考查化学反应方程式的计算,为高频考点,把握电子守恒、原子守恒的计算为解答的关键,侧重分析能力、计算能力的考查,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 二氧化硅在电子工业中,是最重要的半导体材料 | |
| B. | 硅是构成矿物和岩石的主要元素,硅在地壳中的含量在所有的元素中居第一位 | |
| C. | 硅的化学性质不活泼,在自然界中可以以游离态存在 | |
| D. | 光导纤维是以二氧化硅为主要原料制成的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ag+ K+ MnO4- Cl- | B. | Na+ H+ NO3- SO42- | ||
| C. | K+ Ca2+ NO3- CO32- | D. | Cu2+ Na+ Cl- SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 电解饱和食盐水制烧碱采用离子交换膜法,可以阻止阳离子通过 | |
| B. | 在铁上镀锌时,锌棒作阳极,且电解液硫酸锌的浓度是不变的 | |
| C. | 用惰性电极电解Na2SO4溶液,阴阳两极产物的物质的量之比为1:2 | |
| D. | 用惰性电极电解饱和NaCl溶液,若有1 mol电子转移,则生成1 molNaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
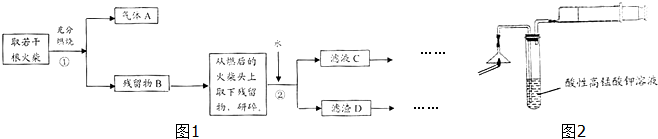
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 上述实验证明氧化性:MnO4->Cl2>Fe3+>I2 | |
| B. | 上述实验中,共有两个氧化还原反应 | |
| C. | 实验①生成的气体不能使湿润的淀粉KI试纸变蓝 | |
| D. | 实验②证明Fe2+有还原性,保存FeCl2溶液时,要向溶液中加入少量铁粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8g | B. | 15.5g | C. | 11.7g | D. | 无法确定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com