
| A. | 原子晶体中,共价键的键能越大,熔沸点越低 | |
| B. | 分子晶体中,分子间作用力越大,该分子越稳定 | |
| C. | 金属阳离子只能与阴离子构成晶体 | |
| D. | 甲烷分子中,键角为109.5° |
 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案科目:高中化学 来源: 题型:选择题
| 化学键 | H-H | C-O | C O | H-O | C-H |
| E/(kJ.mol-1) | 436 | 343 | 1076 | 465 | 413 |
| A. | 99、-41 | B. | +99、+41 | C. | -99、+41 | D. | -99、41 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +262.6 kJ•mol-1 | B. | -131.3 kJ•mol-1 | C. | +131.3 kJ•mol-1 | D. | -352.3 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①③ | C. | ②④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 将一定量的A、B、C三种物质(都是气体)放入固定体积为10L的密闭容器中,一定条件下发生反应,一段时间内测得各物质的物质的量变化如图所示.
将一定量的A、B、C三种物质(都是气体)放入固定体积为10L的密闭容器中,一定条件下发生反应,一段时间内测得各物质的物质的量变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
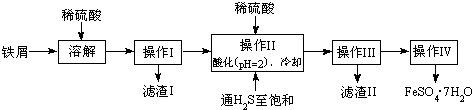
| 25℃时 | pH值 |
| 饱和H2S溶液 | 3.9 |
| SnS沉淀完全 | 1.6 |
| FeS开始沉淀 | 3.0 |
| FeS沉淀完全 | 5.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com