
| A. | 等质量的NaHCO3和Na2CO3与足量盐酸反应,在相同条件下NaHCO3产生的CO2体积大 | |
| B. | 等物质的量的两种盐与同浓度盐酸完全反应,所消耗盐酸的体积Na2CO3是NaHCO3的两倍 | |
| C. | 将石灰水加入NaHCO3溶液中无沉淀,加入Na2CO3溶液中有白色沉淀 | |
| D. | 等浓度的两种盐溶液分别与等浓度的盐酸反应,碳酸氢钠溶液的反应速率快 |
分析 A.等质量的Na2CO3和NaHCO3,NaHCO3物质的量较多,生成二氧化碳多;
B.由方程式Na2CO3+2HCl=2NaCl+CO2↑+H2O,NaHCO3+HCl=NaCl+CO2↑+H2O分析解答;
C.都与澄清石灰水反应生成沉淀:Ca(OH)2+Na2CO3=CaCO3↓+2NaOH,2NaHCO3+Ca(OH)2=CaCO3↓+Na2CO3+2H2O(NaHCO3足量);
D.分别滴加HCl溶液,反应离子方程式为CO32-+2H+═CO2↑+H2O,HCO3-+H+═H2O+CO2↑.
解答 解:A.根据反应的方程式Na2CO3+2HCl=2NaCl+CO2↑+H2O,NaHCO3+HCl=NaCl+CO2↑+H2O可知,106g碳酸钠完全反应生成1mol二氧化碳,84g碳酸氢钠完全反应生成1mol二氧化碳,所以等质量的NaHCO3和Na2CO3与足量盐酸反应,在相同条件下NaHCO3产生的CO2体积大,故A正确;
B.由方程式Na2CO3+2HCl=2NaCl+CO2↑+H2O,NaHCO3+HCl=NaCl+CO2↑+H2O可知,等物质的量的两种盐与同浓度盐酸完全反应,所消耗盐酸的体积Na2CO3是NaHCO3的两倍,故B正确;
C.都与澄清石灰水反应生成沉淀:Ca(OH)2+Na2CO3=CaCO3↓+2NaOH,2NaHCO3+Ca(OH)2=CaCO3↓+Na2CO3+2H2O(NaHCO3足量),两者都有白色沉淀,故C错误;
D.分别滴加HCl溶液,反应离子方程式为CO32-+2H+═CO2↑+H2O,HCO3-+H+═H2O+CO2↑,相同条件下NaHCO3比Na2CO3反应放出气体剧烈,故D正确;
故选C.
点评 本题考查了碳酸钠和碳酸氢钠的性质,为高频考点,题目难度不大,明确物质的性质、把握有关化学方程式的计算是解题关键,注意碳酸钠与盐酸反应的原理.


科目:高中化学 来源: 题型:选择题
| A. | 一定有甲烷 | B. | 一定有乙烯 | C. | 可能有乙烷 | D. | 一定有丙炔 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8个中子的碳原子的核素符号:14C | |
| B. | 碳酸氢钠的电离方程式:NaHCO3=Na++H++CO32- | |
| C. | Cl-离子的结构示意图 | |
| D. | 氯化钠的电子式: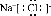 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
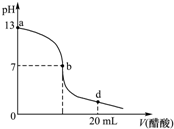 常温下,向20mL氢氧化钠溶液中逐滴加入0.2mol/L醋酸溶液,滴定曲线如下图所示,下列说法不正确的是( )
常温下,向20mL氢氧化钠溶液中逐滴加入0.2mol/L醋酸溶液,滴定曲线如下图所示,下列说法不正确的是( )| A. | 氢氧化钠溶液与醋酸溶液恰好完全反应的点位于曲线b、d间的某点 | |
| B. | 在b点,c(Na+)=c(CH3COO-) | |
| C. | 在d点,溶液中所有离子浓度由大到小的顺序为c(CH3COO-)>c (Na+)>c (H+)>c (OH-) | |
| D. | 该氢氧化钠溶液的物质的量浓度为0.1 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氟酸存放在带橡皮塞的棕色试剂瓶中 | |
| B. | Ca(OH)2溶液存在配磨口玻璃塞的棕色试剂瓶中 | |
| C. | NaOH溶液存放在带橡皮塞的细口玻璃瓶中 | |
| D. | NaOH固体盛放在带橡皮塞的细口玻璃瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 自然界中大量存在硅单质 | |
| B. | 石英、水晶、硅石的主要成分都是SiO2 | |
| C. | 自然界中SiO2都存在于石英矿中 | |
| D. | SiO2为集成电路和光电池的材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | BaCl2、H2SO4、MgCl2 | B. | CaCl2、HNO3、BaCl2 | ||
| C. | CaCl2、HNO3、NaCl | D. | BaCl2、HCl、Na2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 (1)科学家正在研究温室气体CH4和CO2的转化和利用.
(1)科学家正在研究温室气体CH4和CO2的转化和利用.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com