
【题目】三草酸合铁酸钾晶体K3[Fe(C2O4)3]·3H2O可用于摄影和蓝色印刷,它受热易分解,为了验证其气态产物,某同学设计了如下实验装置:

(1)若实验中,观察到B、E中的溶液均变浑浊,则D中的现象是_______________________________;
说明其气态产物是________、________;为验证另一种气态产物,应在A、B之间增加的装置为____________。
(2)为了使实验更安全、更严密,你认为该实验设计需要如何改进?
①________________________________;
②_________________________________。
(3)固体产物中铁元素不可能以+3价形式存在,理由是__________________________。
现设计实验,探究固体产物中铁元素的存在形式。
①提出合理假设。
假设1:____________________________;
假设2:____________________________;
假设3:____________________________。
②某学生设计实验探究上述假设,除3%H2O2、蒸馏水外,还需要下列试剂中的____________________________________。
限选试剂:浓硫酸、1.0 mol·L-1HNO3、1.0 mol·L-1盐酸、1.0 mol·L-1NaOH溶液、0.1 mol·L-1KI溶液、0.1 mol·L-1CuSO4溶液、20%KSCN溶液。
【答案】(1)溶液褪色或变浅 CO2 CO 盛有无水CuSO4的干燥管
(2)①在B装置之前加一个防倒吸装置 ②在C装置后增加一个检验二氧化碳是否除尽的装置(或盛有澄清石灰水的试管)
(3)有还原性气体CO生成,能将三价铁还原,故不可能有三价铁存在
①铁元素的存在形式为Fe单质 铁元素的存在形式为FeO 铁元素的存在形式为Fe与FeO的混合物
②1.0 mol·L-1盐酸、20%KSCN溶液、0.1 mol·L-1CuSO4溶液
【解析】(1)B中溶液变浑浊说明气态产物中有CO2,E中溶液变浑浊说明CO被酸性高锰酸钾溶液氧化为CO2,故D中的现象是溶液褪色或变浅,从而可说明气态产物有CO;另一种气态产物是H2O,其验证方法是将A中产生的气体通过盛有无水CuSO4的干燥管。(2)从安全角度考虑应在B装置前加一个防倒吸装置,从严密性角度考虑,要在C装置后增加一个检验CO2是否除尽的装置。(3)①由于反应过程中有CO生成,能还原三价的铁,故固体产物中无三价铁,其成分可能有三种情况:Fe、FeO、Fe和FeO。②探究固体产物中铁元素的存在形式;可以将固体产物放入足量的0.1 mol·L-1的CuSO4溶液中搅拌使其充分反应,然后过滤洗涤沉淀,再加入足量的1.0 mol·L-1的盐酸,若溶液中有不溶的红色物质,则说明固体产物中含有Fe(发生反应为Fe+CuSO4===FeSO4+Cu),向溶液中加入20%KSCN溶液,不变红色,然后再向溶液中滴加双氧水,若变红色,则说明固体产物中含有FeO。


科目:高中化学 来源: 题型:
【题目】溶质分子(或离子)和水分子结合后成水合分子(水合离子)的过程是( )
A.物理过程,吸收热量
B.化学过程,吸收热量
C.物理过程,放出热量
D.化学过程,放出热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是中学常见的仪器或装置:

请回答下列问题:
(1)分离硝基苯和苯的混合物得到硝基苯,需要选用的仪器是________(填代号,下同),还需要的玻璃仪器有________种(填数字)。
(2)除去乙烷中的少量乙烯,选择装置________,试剂名称是________。
(3)实验室用浓盐酸和浓硫酸制少量氯化氢,发生装置选择A而不选择C,其主要原因是__________________________。使用C装置制备气体时,必须将长颈漏斗下端插入液面下,目的是_______________________________________。
(4)用D装置验证过氧化钠与SO2是否发生了反应,能证明已发生反应的实验现象是___________________________;
导出气体中一定含有的气体是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在提纯混有少量氯化钾的硝酸钾时,第一步操作应
A.在常温下将混合物溶于水中形成浓溶液
B.在常温下将混合物溶于水中形成稀溶液
C.在较高温度下将混合物溶于水中形成浓溶液
D.在较高温度下将混合物溶于水中形成稀溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2 L的密闭容器中发生如下反应:A(s)+2B(g) ![]() xC(g) △H<0,B、C的物质的量随时间变化的关系如图1,达平衡后在t1、t2、t3、t4时都只改变了一种条件,逆反应速率随时间变化的关系如图2
xC(g) △H<0,B、C的物质的量随时间变化的关系如图1,达平衡后在t1、t2、t3、t4时都只改变了一种条件,逆反应速率随时间变化的关系如图2
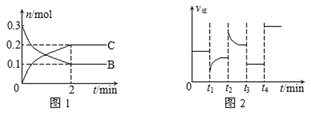
下列有关说法正确的是
A. x=2,反应开始2 min内,v(A)=0.05 mol/(L·min)
B. t1时改变的条件是降温,平衡逆向移动
C. t2时改变的条件可能是增大C的浓度,t2时正反应速率减小
D. t3时可能是减小压强,平衡不移动;t4时可能是使用催化剂,c(B)不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝(AlN)是一种新型无机非金属材料,某AlN样品仅含有Al2O3杂质,为测定AlN的含量,设计如下实验方案。
(1)实验原理。
AlN溶于浓的强碱生成氨气,请写出AlN与NaOH溶液反应的化学方程_________。
(2)实验装置。

如图C装置中球形干燥管的作用是_________________________。
(3)实验过程。
①连接好实验装置________,然后称得C装置的质量为yg。
②称取xg AlN样品置于A装置中;塞好胶塞,关闭________打开________(填“K1”或“K2”);通过分液漏斗加入NaOH浓溶液,至不再产生气体。打开K1,通入氮气一段时间,称得C装置的质量变为zg,通入氮气的目的是__________________,装置B的作用是__________________________。
(4)数据分析。
①AlN的质量分数为________。(相对原子质量Al:27,N:14)
②由于装置存在缺陷,导致测定结果偏高,请提出改进意见________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于燃料充分利用的说法错误的是( )
A.热能要充分利用
B.燃料充分燃烧时输入的空气量越多越好
C.固体燃料燃烧前要粉碎
D.液体燃料燃烧时可以雾状喷出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中进行反应:2SO2(g)+O2(g) ![]() 2SO3(g)。已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.4mol/L、0.2mol/L、0.4mol/L,当反应达平衡时,可能存在的数据是
2SO3(g)。已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.4mol/L、0.2mol/L、0.4mol/L,当反应达平衡时,可能存在的数据是
A. SO2为0.8mol/L,O2为0.4mol/L
B. SO2为0.5mol/L
C. SO3为0.8mol/L
D. SO2、SO3一定均为0.3mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子中,能在同一溶液中大量共存,加入一小块钠后仍能大量共存的是( )
A.Na+、K+、Cl﹣、CO32﹣
B.Cu2+、Na+、SO42﹣、NO3﹣
C.Ba2+、K+、Cl﹣、SO42﹣
D.K+、Na+、HCO3﹣、CO32﹣
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com