
 已知反应:2NO2(g)?N2O4(g),△H<0,为了探究温度对化学平衡的影响,有人做了如图实验:把NO2和N2O4的混合气体通入甲、乙两个连通的烧瓶里,然后用夹子夹住橡皮管,把两烧瓶分别浸入两个分别盛有500mL 6mol/L的HCl溶液和盛有500mL蒸馏水的烧杯中(两烧杯中溶液的温度相同).
已知反应:2NO2(g)?N2O4(g),△H<0,为了探究温度对化学平衡的影响,有人做了如图实验:把NO2和N2O4的混合气体通入甲、乙两个连通的烧瓶里,然后用夹子夹住橡皮管,把两烧瓶分别浸入两个分别盛有500mL 6mol/L的HCl溶液和盛有500mL蒸馏水的烧杯中(两烧杯中溶液的温度相同).分析 (1)试验中用两个经导管连通的烧瓶,可以使两个烧瓶的起始状态完全相同,起到对照作用;
(2)根据温度对化学平衡的影响分析,氢氧化钠溶解和盐酸中和反应都使溶液温度升高,硝酸铵溶解溶液温度降低,2NO2(g)?N2O4(g)△H<0,依据化学平衡移动原理分析,升温平衡向吸热方向进行,降温平衡向放热反应方向进行,二氧化氮是红棕色气体,四氧化二氮是无色气体;
(3)根据温度对可逆反应的影响进行分析;
(4)该反应中有气体参与,温度改变后气体体积也改变,压强也会影响化学平衡.
解答 解:(1)该实验用两个经导管连通的烧瓶,确两个个烧瓶中可逆反应的起始平衡状态完全相同,便于对比,
故答案为:使两个烧瓶中可逆反应的起始平衡状态完全相同,便于对比;
(2)因NaOH溶于水以及与NaOH与HCl的反应都是放热反应,所以烧杯甲的溶液的温度升高,温度升高,平衡2NO2(g)?N2O4(g)△H<0向吸热方向移动,即逆反应方向移动,NO2浓度增大,颜色加深;
因NH4NO3溶于水是吸热的,使体系温度降低,使平衡2NO2(g)?N2O4(g)△H<0向放热热方向移动,即反应方向移动,NO2浓度减小,颜色变浅,
故答案为:变深;NaOH溶解放热,中和HCl也放热,使甲瓶气体温度升高,平衡逆向移动,c(NO2)增大;变浅;NH4NO3溶解吸热,乙烧瓶气体的温度降低,平衡2NO2,N2O4向正反应方向移动,使NO2的浓度减小;
(3)根据实验现象可知,改变温度后化学平衡发生移动:升温平衡向吸热方向移动,降温平衡向放热反应方向移动,
故答案为:升温平衡向吸热方向移动,降温平衡向放热反应方向移动;
(4)该反应中,改变温度后,容器内气体的压强也会改变,而压强对该可逆反应同样会产生影响,所以该实验设计并不完全科学,
故答案为:压强.
点评 本题考查了影响化学平衡的因素,题目难度中等,注意掌握温度、压强、浓度对因素对化学平衡的影响,试题侧重考查学生的分析、理解能力及化学实验能力.


科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②③⑥ | C. | ②④⑤ | D. | ③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
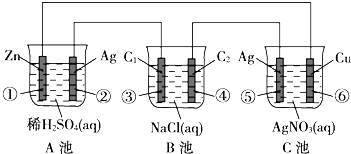 已知金属活动性相差越大,形成原电池时越容易放电.请根据如图装置,回答下列问题:(其中C1、C2都为石墨电极)
已知金属活动性相差越大,形成原电池时越容易放电.请根据如图装置,回答下列问题:(其中C1、C2都为石墨电极)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | m=$\frac{36.5V}{22.4}$ | B. | ω=$\frac{36.5c}{1000ρ}$ | ||
| C. | c=$\frac{1000ρV}{36.5V+22400}$ | D. | c=$\frac{V}{22.4+22.4V}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑥⑦ | B. | ②④⑤ | C. | ①③⑥ | D. | ③④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某研究型学习小组为测定镁和铝的混合物中铝的质量分数,称取该样品a g,溶于200mL 5mol/L HCl溶液中,共收集到标准状况下的氢气3.36L.
某研究型学习小组为测定镁和铝的混合物中铝的质量分数,称取该样品a g,溶于200mL 5mol/L HCl溶液中,共收集到标准状况下的氢气3.36L.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶于水时,HI分子比HCl分子更容易电离 | |
| B. | HI比HCl熔、沸点都高 | |
| C. | HI比HCl更稳定 | |
| D. | 拆开相同物质的量的HI分子比HCl消耗的能量小,HI是离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
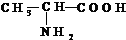 ,请回答下列问题.
,请回答下列问题. .
. 为:CH2=CHCN、CH2=CHCH=CH2、CH2=CHC6H5.
为:CH2=CHCN、CH2=CHCH=CH2、CH2=CHC6H5.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com